人類免疫缺陷病毒
| 人類免疫缺陷病毒 | |
|---|---|

| |
| 从培养的淋巴细胞出芽的HIV-1(绿色)的扫描电子显微镜照片。细胞表面的多圆颠簸代表病毒聚集的地点和病毒粒子的出芽释放。 | |
|
病毒分類 | |
| –未分级–: | 病毒 Virus |
| 域: | 核糖病毒域 Riboviria |
| 界: | 副核糖病毒界 Pararnavirae |
| 门: | 逆转录酶病毒门 Artverviricota |
| 纲: | 逆转录酶病毒纲 Revtraviricetes |
| 目: | 逆转录病毒目 Ortervirales |
| 科: | 逆转录病毒科 Retroviridae |
| 属: | 慢病毒属 Lentivirus |
| 种: | 人類免疫缺陷病毒 Human immunodeficiency virus |
| 种类 | |
人類免疫缺乏病毒(英語:human immunodeficiency virus,簡稱HIV,又稱愛滋病毒)是一種感染人類免疫系統細胞的慢病毒,屬反轉錄病毒的一種。普遍認為,人類免疫缺乏病毒的感染導致艾滋病,艾滋病是後天性細胞免疫功能出現缺陷而導致嚴重隨機感染及/或繼發腫瘤並致命的一種疾病。愛滋病毒起源於1920年代的非洲金沙萨,自1981年在美國被識別 並發展為全球大流行。人類免疫缺乏病毒通常也俗稱為「艾滋病病毒」或「艾滋病毒」。
人類免疫缺乏病毒作為反轉錄病毒,在感染後會整合入宿主細胞的基因組中,而目前的抗病毒治療並不能將病毒根除。2016年世界衛生組織(WHO)估計,全球約有3670萬名愛滋病毒感染者,流行狀況最為嚴重的是撒哈拉以南非洲、其次是南亞與東南亞,成長幅度最快的地區是東亞、東歐及中亞。
在人類免疫缺乏病毒感染病程的一些時期,特別是早期及末期,具有感染性的病毒顆粒會存在於含有免疫細胞、血漿、淋巴液或組織液的某些體液中,如血液、精液、前列腺液、陰道分泌液、乳汁或傷口分泌液;另一方面,病毒在體外環境中極不穩定。因此,人類免疫缺乏病毒的傳播途徑主要是不安全性行為、靜脈注射、輸血、分娩、哺乳等;而通常的工作、學習、社交或家庭接觸,比如完整皮膚間的接觸、共用坐便器、接觸汗液等,不會傳播人類免疫缺陷病毒;與唾液或淚液的通常接觸(如社交吻禮或短暫接吻)也未有導致傳播人類免疫缺陷病毒的報告;但美國疾病控制與預防中心說已感染病毒的母親,可將病毒透過先嚼過的食物(唾液內含血液)傳給孩子。
目录
與愛滋病的差異
雖然HIV與愛滋病(Acquired Immune Deficiency Syndrome, 簡稱AIDS,又稱後天免疫缺乏症候群)常一起提到,但是兩者是不同的概念。簡單來說,HIV指的是「病毒」,但是愛滋病指的是因免疫系統能力下降而出現的「感染」, HIV感染者不會馬上發病,而是要呈現發病的狀況才會稱為愛滋病。
歷史與現狀
起源
病毒最早出現在1920年代的非洲金沙萨,由非洲中西部的灵长类动物傳給人類,後來愛滋病毒由此處開始蔓延全球。
發現
艾滋病最早是於1981年在美國被識別,受到當時里根保守政府的忽視。但在美國疾病控制與預防中心以及有識的醫生與科學家的持續工作下,累積了信服性的流行病學數據,顯示艾滋病有一定的傳染性致因。
在巴黎巴斯德研究所專門研究逆轉錄病毒與癌症關係的法國病毒學家吕克·蒙塔尼及其研究組於1983年首次從一位罹患晚期卡波西氏肉瘤的愛滋病人(首字縮寫LAI)的血液及淋巴結樣品中,分離到一種的新的反轉錄病毒;他們發現這種病毒不同於人類T細胞白血病病毒,而是一種慢病毒,他們將之命名為「免疫缺陷相關病毒」(Immune Deficiency-Associated Virus, IDAV)。大西洋另一邊,蒙塔尼埃當時的合作者,美國國家癌症研究所的美國生物醫學科學家羅伯特·加羅(Robert Gallo)及屬下也從一些細胞株系中分離到新病毒,並將之命名為「IIIB/H9型人類T細胞白血病病毒」(Human T cell Leukemia Virus-IIIB/H9, HTLV-IIIB/H9);加羅小組首次於1984年在《科學》期刊發表論文,論證了這種新病毒與艾滋病的病原關係。
隨後加羅前往法國,提供HTLV-IIIB/H9以與蒙塔尼埃的IDAV (LAI)比較,結果兩株病毒是完全一樣的。本來雙方約定共同舉行新聞發布會,但已經知情的美國健康與人類服務部(DHHS)部長瑪格理特·海克勒(Margaret Heckler)緊急電召加羅回國,單方面舉行了新聞發布會。DHHS指示加羅儘速開發在血液中檢測人類免疫缺陷病毒的技術並申請專利,以方便美國的製藥公司在全球銷售這一技術,加羅使用了這種HTLV-IIIB/H9病毒。法美兩國以及雙方的科學家為此有若干年的爭議與官司,一直無解;持續到1991年,雙方才達成某些程度的諒解。
1986年,該病毒的名稱被統一為「人類免疫缺陷病毒」(Human Immunodeficiency Virus, HIV),以更明確的反映出病毒導致免疫缺陷而不是導致癌症的性質。
全球大流行
根據世界衛生組織的HIV/AIDS統計報告 (页面存档备份,存于互联网档案馆),在2004年,全球估計有四千萬人(3590至4430萬人)與人類免疫缺陷病毒相伴生存(被感染),其中五百萬人(430至640萬人)屬於新發感染病例,另外,有三百萬人(280至350萬人)死於艾滋病。這些數字並在不斷增長中,其中,東亞、東歐、中亞等地區漲幅最快。感染最嚴重的地區仍然是撒哈拉以南非洲,其次是南亞與東南亞。
U=U
測不到(undetectable)=不具傳染力(untransmittable)
2016年7月,由感染者與相關領域專家發起的共識聲明。
有來自100個國家的760 組織認同,佐證文獻來源包含美国疾控中心(CDC)、美国国家过敏症和传染病研究所(NIH)、联合国艾滋病规划署(UNAIDS)、柳叶刀杂志(Lancet),中文版聲明由社團法人台灣露德協會翻譯。
HIV 90-90-90
2014 年世界衛生組織(WHO)公布防治目標「HIV 90-90-90」:2020年,90%感染者知道自己病況、90%知道病況者服用藥物、90%服用藥物者病毒量成功抑制
2018年荷蘭,阿姆斯特丹已達成此防治目標,數據為:94-93-95
2018年8月台灣的防治進度:79-87-90。
阴谋论
冷战時期,蘇聯國家安全委員會(KGB)為了詆毀美國,精心策劃了一場宣傳運動,指稱HIV病毒是美國實驗室製造出來的生化武器。此假说由生物學家同時也是KGB特工的雅各布·塞加爾提出,稱愛滋病由兩種不同的病毒混合而成。
生物學
| 亚型 | 致病性 | 感染性 | 传播范围 | 跨物种来源 |
|---|---|---|---|---|
| HIV-1 | 高 | 高 | 全球 | 黑猩猩 |
| HIV-2 | 较低 | 低 | 西非 | 乌白眉猴 |
人類免疫缺陷病毒(HIV)屬於慢病毒屬,是一種潛伏期極長的逆轉錄病毒。HIV分為兩型:HIV-1與HIV-2。多數國家的HIV感染是由HIV-1造成的,並且感染HIV-1後超過90%的患者會在10-12年內發病成為艾滋病;HIV-2主要分布在西部非洲,其感染往往沒有相關的病症。
演化史

HIV-1與HIV-2兩者都來自非洲中西部,並從靈長類動物傳到人類。HIV-1可能是從黑猩猩的猴免疫缺陷病毒跨種感染演化而來;HIV-2則可能是從幾內亞比索的烏白眉猴(Sooty Mangabey, Cercocebus atys)的另一種猴免疫缺陷病毒跨種感染而來。
結構
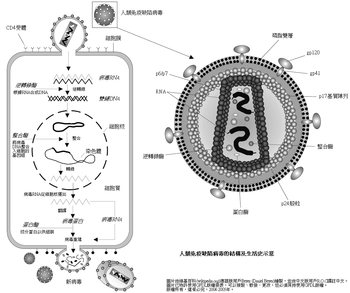
人類免疫缺陷病毒直徑約120納米,呈二十面体。病毒外膜是磷脂雙分子層,來自宿主細胞,並嵌有病毒的蛋白gp120與gp41;gp41是跨膜蛋白,gp120位於表面,並與gp41通過非共價作用結合。向內是由蛋白p17形成的球形基質(Matrix),以及蛋白p24形成的半錐形衣殼(Capsid),衣殼在電鏡下呈高電子密度。衣殼內含有病毒的RNA基因組、酶(逆轉錄酶、整合酶、蛋白酶)以及其他來自宿主細胞的成分(如tRNAlys3,作為逆轉錄的引物)。
基因組及其表達與調控
病毒基因组是兩條相同的正股RNA,每條RNA长约9.2-9.8kb。兩端是長末端重複序列(long terminal repeats, LTR),含顺式调控序列,控制前病毒的表达。已证明在LTR有启动子和增强子并含负调控区。LTR之間的序列編碼了至少9個蛋白,可分為三類:結構蛋白、調控蛋白、輔助蛋白。
- 結構蛋白
- Gag
- gag基因產生55kD的蛋白p55。p55由病毒編碼的一個蛋白酶切成四個小蛋白:MA(p17基質)、CA(p24衣殼)、NC(p9核衣殼)、及p6。
- Pol
- Gag-Pol融合蛋白是經過mRNA上一個順式調控模件(cis-acting motif)導致的核糖體移位(frame shifting)事件產生,使得pol基因的閱讀框(reading frame)被使用。這種情況發生的機率是5%,所以,Gag與Gag-Pol產物的比率維持在20:1。融合蛋白由病毒編碼的一個蛋白酶切為四個小蛋白:Pro(p10蛋白酶)、RT(p50逆轉錄酶)、RNase H(p15 RNA酶H)、及IN(p31整合酶)。
- Env
- Env起先是160kD的蛋白,在高爾基體中經糖基化,在天冬酰胺上被加上25至30個複雜的N連糖鏈,成為gp160;這個糖基化過程對感染性是必要的。之後,宿主細胞的一個蛋白酶將gp160切為gp41與gp120。
- 調控蛋白
- Tat
- Tat是一抗终止蛋白,可以促使HIV的基因呈有效表达,它作用机制是使RNA-pol II在经过转录终止点的时候能够继续转录,避免HIV基因组过早的停止转录过程。
- 輔助蛋白
- Vpu
-
- Vpr
- Vif
- Nef
生活史
人類免疫缺陷病毒感染多種細胞,包括CD4陽性輔助T細胞與巨噬細胞等在表面表達CD4分子的細胞。病毒進入輔助T細胞或巨噬細胞不僅僅是透過病毒顆粒被膜的糖蛋白gp120與被感染細胞的CD4分子之間的相互作用來介導,而是同時需要宿主細胞表面的趨化因子受體來作為協同受體。嗜M(巨噬細胞)型(macrophage (M)-tropic)人類免疫缺陷病毒(或稱做「非合胞誘導型株」,non-syncitia-inducing strains, NSI)利用乙類趨化因子(beta-chemokine)受體CCR5進入細胞,因而可以在巨噬細胞與CD4陽性輔助T細胞中複製。嗜T型(T cell (T)-tropic)人類免疫缺陷病毒(或稱做「合胞誘導型株」,syncitia-inducing strains, SI)使用甲種趨化因子(alpha-chemokine)受體,因為主要在CD4陽性輔助T細胞中複製,儘管也可以在巨噬細胞中複製。僅使用CCR5受體進入細胞的病毒,稱為R5;僅使用CXCR4受體的,稱為X4;兩者都使用的,則稱為X4R5。當然根據協同受體分型並不一定區分病毒的實際細胞嗜性。
人類免疫缺陷病毒也可感染樹狀細胞。
糖蛋白gp120與其協同受體及CD4分子的相互作用,引發gp120蛋白構象的改變,從而將跨膜糖蛋白gp41原本深埋的部份曝露,進而使gp120的V3環接近協同受體,然後gp41導致病毒被膜與靶細胞膜的融合,使病毒核衣殼進入細胞。gp41導致細胞膜融合的具體機制仍未明瞭。
有些人群對HIV有較高的抵抗力(但並不是完全抵抗),是因為他們的細胞缺少HIV進入細胞的一個協同受體(co-receptor),這個協同受體是趨化因子受體CCR5。他們的CCR5基因有一段長為32鹼基對的缺失(deletion),造成產物蛋白嚴重截斷(truncated),不能在細胞表面探測到。這些人主要分布在歐洲,也有分布在中東及印度次大陸。
HIV作為病毒,必須進入細胞才能繼續其生活史(整合、複製、釋出…)及感染史。病毒透過其表面的gp120糖蛋白與靶細胞表面的細胞分化抗原(或稱分化簇)CD4分子作用,與靶細胞的細胞膜融合並進入細胞。這個過程需要靶細胞表面的一個七次跨膜的G蛋白耦聯受體,目前發現的主要為趨化因子受體CCR5(嗜M的病毒株)及CXCR4(嗜T的病毒株)。
具有該CCR5缺失的人,因為細胞表面不表達CCR5,使部分HIV不能進入並感染這類細胞。但HIV可以透過其他協同受體感染這類細胞,或者其他類型的細胞不需要此CCR5就可以被感染,所以這些人並不能完全抵抗HIV。事實上,已有該CCR5缺失的純合個體感染HIV的病例報告。
病毒核衣殼一旦進入細胞,病毒的逆轉錄酶就將病毒的單鏈正意RNA從病毒蛋白上釋放,並根據正意RNA逆轉錄生成反意互補DNA(cDNA)。這個反轉錄過程非常容易出錯,因此這是病毒進行突變(如,獲得抗藥性)的重要步驟。然後,根據cDNA合成雙鏈的病毒DNA(vDNA)。新的病毒DNA被轉運到細胞核中,並由病毒的整合酶將其整合到宿主的基因組上。這樣,病毒完成感染開始進入潛伏期。
要啟動病毒,細胞中需要存在一些轉錄因子。最重要的一種叫做NF-κB,存在於所有被啟動的T細胞中。這就意味著,最容易被人類免疫缺陷病毒殺死的細胞,恰恰是那些正在參與感染作戰的細胞。
醫學
| 感染途徑 | 估計感染幾率 |
|---|---|
| 輸血 | 90% |
| 分娩(傳給胎兒) | 25% |
| 注射性毒品使用共用針頭 | 0.67% |
| 经皮针扎 | 0.30% |
| 肛交受方* | 0.50% |
| 肛交插入者* | 0.065% |
| 陰莖陰道交媾女方* | 0.10% |
| 陰莖陰道交媾男方* | 0.05% |
| 口交接受者 *§ | 0.01% |
| 口交插入者*§ | 0.005% |
|
* 假設未使用安全套 § 資料指的口交 是男性作出的 | |
傳播途徑
愛滋病毒是透過交換體液來傳播的,具體是指:
最常見的傳染途徑是:進行陰道或肛門性交,共用沾污了的針筒,受病毒感染的母親傳播給嬰兒 (懷孕、分娩或哺乳)。 相反,以下途徑不傳播病毒:
預防
正確的避孕套可大幅降低感染HIV的機率,但亦非天衣無縫。
暴露愛滋病毒「後」預防性投藥( Post-Exposure Prophylaxis, PEP):暴露於感染風險後(如發生危險性行為、針扎或其他血液體液交換接觸),72小時内服用抗愛滋病毒藥物(每次療程28天)可有效降低愛滋病毒感染機率。
治療作為預防(Treatment as Prevention):已感染者服用愛滋病藥物對預防傳播的效果極佳,血清相異伴侶中之血清陽性一方可經由穩定服藥,避免將病毒傳染給陰性之一方。
暴露愛滋病毒「前」預防性投藥( Pre-Exposure Prophylaxis, PrEP):於暴露愛滋病毒之風險行為前使用抗愛滋病毒藥物也可大幅減少服用期間的感染機率。目前針對PrEP的藥物,僅有舒發泰一款,分為每日服用(daily)或有可能感染前先服用(event-driven)。針對愛滋病毒血清相異伴侶而言,陰性之一方若每日服用,其避免感染愛滋病毒的效果可達100%。
體徵與症狀
通常是發生伺機性感染的疾病,如卡波西氏肉瘤、肺囊蟲肺炎,才被發現。此外還會出現體重急遽減輕。持續發燒。淋巴腺腫大等症狀。會入侵人類免疫細胞並加以破壞。
實驗室診斷
實驗室檢驗人類免疫缺陷病毒感染主要分成兩階段, 第一階為篩檢法,利用酵素免疫法(Enzyme immunoassay, EIA)、微粒凝集法(Paraticle agglutination)或快速篩檢法(Rapid test)做初步檢測,因偽陽性率甚高,因此若篩檢為陽性時應再以第二階段的確認試驗做確診,確認試驗主要有西方墨點法(Western blot)、核酸分析法(Nucleic Acid Testing, NAT)和p24抗原中和試驗(Neutralization test)。
其中,酵素免疫法(Enzyme immunoassay, EIA)目前已發展到能同時檢測抗體和病毒p24抗原的第四代檢驗試藥,即疾病管制署所稱的愛滋抗原/抗體複合型檢測(HIV antibody and antigen combination assay)篩檢 (页面存档备份,存于互联网档案馆),能大幅縮短空窗期至一到二星期,在台灣,使用複合型檢驗法的實驗室於2012年已經達56.3%之多。
若非使用愛滋抗原/抗體複合型檢測法來檢驗是否感染愛滋病毒,則需等到抗體產生後才能經由篩檢法驗出,感染至抗體產生的期間稱作空窗期,平均約是二到八週,0.1%以下比例的少數人會大於這個時間,目前國際間的共識約是十二週。
或是可以使用RT-PCR等方式檢測血中是否帶有病毒的RNA/DNA作為診斷,此方法的空窗期約七至十四天,一般建議為二十八天。但是費用較為昂貴。
治療
今天病人通过服用不同的药物攻击在不同的阶段艾滋病病毒。这些药物包括:
- 抑制蛋白酶抑制艾滋病病毒活动所需要的蛋白酶的活动。通常也可以用来抑制复制活动。如Saquinavir, Indinavir, Ritonavir, Kaletra, Nelfinavir等藥物。
-
抑制逆转录酶(reverse transcriptase inhibitors,RTIs)抑制逆转录酶的活动。逆转录酶是艾滋病病毒用于复制的酶,缺乏这种酶可以阻止艾滋病病毒建立RNA和DNA。它有三种形式:
- 非核苷酸反转录酶抑制剂如Nevirapine, Efavirenz等藥物
- 核苷酸反转录酶抑制剂如齐多夫定(AZT), 司它夫定Stavudine(d4T), Didanosine(ddI), Zalcitabine(ddC), 拉米夫定3TC), Abacavir(AZT+3TC)
- 抑制进入的药物抑制艾滋病通过溶解寄主细胞的膜进入细胞内。
建立对HIV疗法的课题面临很多困难。每一种有效的药物都有副作用,通常是严重的或是致命的。常见的副作用包括严重的恶心、腹泻、肝臟的损毁和衰竭、黄疸、高血脂、糖尿病、脂肪組織移位、貧血、腎結石。致命的副作用包含史蒂芬斯-強森症候群、猛暴性肝炎、胰臟炎、乳酸血症。每一种疗法都要求经常性的血液检查以确定疗效和肝脏功能。
目前台灣單藥錠(Single-Tablet Regimens)抗愛滋病毒藥物組合:
- 舒發錠/亞翠佩 (Atripla) = Tenofovir (惠立妥) + Emtricitabine (類似速汰滋) + Efavirenz (希寧)
- 康普萊 (Complera)
- 三恩美 (Triumeq)
- 安以斯 (Odefsey)
- 吉他韋 (Biktarvy)
预断
如果不进行治疗,根据HIV不同亚型,感染艾滋病毒后的的净存活时间平均为9至11年,而诊断为AIDS之后,如果在资源受限导致无法治疗的情况下,根据不同的研究表明,平均存活时间在6至19个月之间。而在医疗资源充足的地区,用高效抗逆转录药物(HAART)的作为有效治疗手段治疗HIV感染者和AIDS患者,可以让死亡率减少80%,并能将新诊断出的HIV感染者的寿命延长最少30年。
随着新的治疗办法不断被研发出来,并且由于HIV持续演化出对这些药物的抗性,对于存活时间的估计可能继续改变。如果没有抗逆转录疗法,患者通常在病情诊断为已发展成AIDS后1年死亡。大多数患者因为免疫系统的持续失效而死于机会性感染或者恶性肿瘤。临床疾病的发病率因为个体的不同而呈现巨大差异,已有研究表明其受许多因素的影响,例如宿主的易感染性和免疫功能,保健措施和交叉感染,以及特定病毒品种的影响。
相關條目
引用
来源
- 英文
- 美國疾病控制與預防中心在艾滋病首次報告二十週年紀念時的專題報告 (页面存档备份,存于互联网档案馆):《发病率和死亡率周报》(Morbidity and Mortality Weekly Report)June 1, 2001 / Vol. 50 / No. 21.
- 加拿大艾滋病的早期歷史
- 人類免疫缺陷病毒的發現歷史(A History of HIV Discovery) (页面存档备份,存于互联网档案馆):路克·蒙塔尼埃(Luc Montagnier)《科學》Volume 298, Number 5599, Issue of 29 Nov 2002, pp. 1727–1728. 美國科學促進會.
- 人類免疫缺陷病毒/艾滋病的早期時代(The Early Years of HIV/AIDS) (页面存档备份,存于互联网档案馆):羅伯特·加羅(Robert Gallo)《科學》Volume 298, Number 5599, Issue of 29 Nov 2002, pp. 1728–1730. 美國科學促進會.
- 中文
外部連結
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||