基因工程
| 遗传学 |
|---|
 |
| 重要概念 |
| 历史及分支 |
| 研究 |
| 個人化醫療 |
| 精準醫學 |
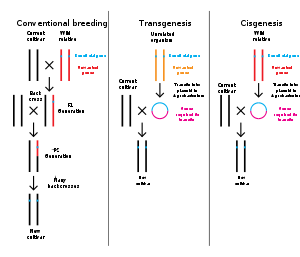
基因工程(英語:Gene engineering)又称遺傳工程(英語:Genetic engineering)、基因操作、基因修饰、重组核酸技术,是一種使用生物技术直接操纵有机体基因组、用于改变细胞遗传物质的工程;此工程技术可以通过使用分子克隆技术分离和复制需要的遗传物质以产生核酸序列,也可以藉由生物工程学方法设计并合成核酸序列,然后以此“外源DNA或RNA”将新的遗传物质插入宿主基因组中,使同一物种或跨物种的基因转移,以产生改良的或新的生物体。
基因工程步骤中,可另外使用核酸酶除去或“敲除”基因;也可进行扩增而制备大量纯化的DNA或RNA片段;更可将靶核酸分子或重组核酸分子插入基因工程载体,接着再导入宿主甚或插入宿主核酸中。基因靶向则是使用同源重组来改变内源基因的不同技术,并且可以用于缺失基因,去除外显子,添加基因或引入点突变。
通过基因工程产生的生物体被认为是“遗传修饰生物体”(GMO)又称“转基因生物”。第一种遗传修饰生物是1973年产生的细菌和1974年的遗传修饰小鼠。利用细菌产生胰岛素在1982年商业化,遗传修饰食品自1994年以来一直销售。作为宠物设计的第一种遗传修饰生物GloFish于2003年12月首先在美国销售。
基因工程技术建立在分子生物学、分子遗传学、基因分子生化学的知识进展上,其已应用于许多领域,包括研究、农业、工业生物技术和医学。用于洗衣洗涤剂和药物如胰岛素和人生长激素的酶现在在遗传修饰(GM)细胞中制造,实验性遗传修饰细胞系和遗传修饰动物例如小鼠或斑马鱼正用于研究目的,并且遗传修饰作物已经商业化。
定义
基因工程是改变生物的遗传组成使用的技术,包括了删除可遗传材料,和将生物体外直接制备的DNA导入宿主或细胞,然后与宿主融合或杂交。 这涉及使用重组核酸(DNA或RNA)技术来形成可遗传材料的新组合,然后通过载体系统(基因工程载体)间接地或通过显微注射、大量注射和微囊化技术直接地掺入该材料。
“基因工程”並不包括传统的动物和植物育种、体外受精、多倍体育种、人工诱变和细胞融合技术,因为在该过程中不使用经过重组核酸或遗传修饰的生物体。欧盟则将“遗传工程”广泛定义为包括选择育种和其他人工选择手段;严格说来,遗传工程(genetic engineering)的范围较基因工程(gene engineering)广泛。克隆和干细胞技术,虽然不被认为是基因工程,但也是与基因工程密切相关的,可以在其中使用基因工程。合成生物学是一个新兴的学科,它使基因工程进一步将人工合成的材料从原材料引入生物体。
如果将来自另一物种的遗传物质添加到某生物体中,则所得生物称为遗传修饰生物。如果使用来自相同物种的遗传物质或可以与宿主自然繁殖的物种,则称为同源基因改造遗传工程也可以用于从目标生物体去除遗传物质,创建一个基因敲除生物体在欧洲,遗传修饰是遗传工程的同义词,而在美国,“基因修饰”一词也可以指常规的育种方法。加拿大的监管制度是基于产品是否具有新颖的特征,而不管来源的方法。换句话说,如果产品携带一些先前在物种中未发现的性状,则其被调节为遗传修饰,无论其是使用传统育种方法(例如选择育种,细胞融合,突变育种)还是遗传工程产生的。在科学界,“基因工程”这个术语并不常用。取而代之的是更为具体的术语,例如“遗传修饰”或“转基因”。
歷史
数千年来,人类通过选择性育种或人工选择。近年来,逐渐通过诱变改变了物种的基因组。而遗传工程作为直接操纵DNA、由人外部育种和突变是自20世纪70年代产生的。
“遗传工程”这个术语最早由杰克·威廉姆森在1951年——也就是DNA在在遗传中的作用得到了阿弗雷德·赫希和玛莎·蔡斯的证实的前一年——出版的科幻小说“龙之岛中创作。1953年,詹姆斯·沃森和弗朗西斯·克里克发现DNA分子具有双螺旋结构。斯丹利·温鲍姆的1936年的科幻故事普罗透斯岛(Proteus Island)中探索了直接遗传操作的一般概念。
1972年,保罗·伯格通过将来自猴病毒SV40的DNA与λ病毒的DNA结合而产生了第一个重组DNA分子。在1973年,赫伯特·博耶和斯坦利·科恩通过将抗生素抗性基因插入到大肠杆菌细菌的质粒中而产生了第一个遗传修饰生物。一年后,鲁道夫·耶尼施通过将外来DNA引入其胚胎中创建了一种遗传修饰小鼠,使其成为世界上第一个遗传修饰动物这些成就导致了科学界对基因工程的潜在风险的关注,这些问题首先在1975年的阿西洛马会议上进行了深入讨论。这次会议的主要建议之一是,在技术的安全性得到确认之前政府应加强对重组DNA研究的监督。 1976年,赫伯特·博耶和羅伯特·史旺森创立了遗传工程公司基因泰克(Genentech),该公司在大肠杆菌中生产了人类蛋白生长抑素。 基因泰克在1978年宣布生产遗传修饰生产的人胰岛素。1980年,美国最高法院在Diamond诉Chakrabarty案中裁定,遗传改变的生命可以获得专利。此種藉由细菌生產的胰岛素以「優泌林」作為品牌名稱,在1982年經美国食品药物监督管理局批准销售。
在20世纪70年代,威斯康辛大学麦迪逊分校的研究生史蒂文·林多(Steven Lindow)与D.C.阿尔尼(D.C.Arny)和C.韦瑟(C.Weather)发现了一种细菌,它被认为是在冰成核过程中发挥作用的丁香假单胞菌,并在1977年发现了一种突变的减冰细菌。 林多博士(现在是加州大学伯克利分校的植物病理学家)后来成功创建了一个重组减冰细菌。1983年,一家生物技术公司先进遗传科学公司(Advanced Genetic Sciences,AGS)申请美国政府授权,使用丁香假单胞菌的减冰菌菌株进行田间试验,以保护作物免受霜冻,但环境组织和抗议者通过法律挑战推迟了此项田间试验四年。 1987年,随着加利福尼亚的草莓田和马铃薯田的喷雾,丁香假单胞菌的减冰菌菌株成为第一个被释放到环境中的遗传修饰生物这两块测试田在测试开始前一天晚上都遭到活动家团体攻击:“世界上第一的试验田吸引了世界第一的捣蛋鬼”。
1986年在法国和美国进行了遗传修饰植物的第一次田间试验,实验植物为一种抗除草剂的遗传修饰烟草。中华人民共和国是第一个将遗传修饰植物商业化的国家,1992年引入了抗病毒的烟草。 在1994年,佳基因公司(Calgene)获批将Flavr Savr番茄(一种具有较长的保质期的遗传修饰番茄)投入市场,同年欧盟批准遗传修饰抗除草剂溴苯腈烟草,使其成为在欧洲商业化的第一个遗传修饰作物。1995年,马铃薯作物Bt Potato在经美国食品药品监督管理局和美国环境保护局批准安全使用,成为美国第一个批准的抗虫遗传修饰作物。
2009年,11个遗传修饰作物在25个国家商业化生产,主要为美国、巴西、阿根廷、印度、加拿大、中国、巴拉圭和南非。
2010年,克莱格·凡特研究所的科学家创建了第一个合成基因组并将其插入空的细菌细胞。得到的细菌,名为“辛西娅”(Synthia),可以复制和产生蛋白质。在2014年,开发了一种细菌,其复制含有独特碱基对(非腺嘌呤、胞嘧啶、胸腺嘧啶、鸟嘌呤)的质粒,是首个使用扩展遗传字母表的生物体。
操作与步驟

如果將一種生物的DNA中的某個遺傳密碼片段連接到另外一種生物的DNA鏈上去,將DNA重新組織一下,就可以按照人類的願望,設計出新的遺傳物質並創造出新的生物類型,這基因工程一般包括以下四個步驟:
- 取得符合要求的DNA片段;
- 构建基因的表达载体;
- 將目的基因导入受体细胞;
- 目的基因的检测与鉴定。
取得符合要求的DNA片段
第一步是选择并分离将被插入到遗传修饰的生物体中的基因。要把目的基因从供体DNA长链准确地剪切下来,可不是一件容易的事。1968年,沃纳·阿尔伯、丹尼尔·内森斯和漢彌爾頓·史密斯第一次从大肠杆菌中提取出了限制性核酸内切酶,它能够在DNA上寻找特定的“切点”,认准后将DNA分子的双链交错地切断。人们把这种限制性内切酶称为“分子剪刀”。这种“分子剪刀”可以完整地切下个别基因。自1970年代以来,人们已经分离提取了400多种“分子剪刀”。有了形形色色的“分子剪刀”,人们就可以随心所欲地进行DNA分子长链的切割了。可以使用限制酶分离基因以将DNA切割成片段并进行凝胶电泳,以根据长度将它们分离出来。聚合酶链反应(PCR)也可以用于扩增基因区段,然后可以通过凝胶电泳分离。 如果所选择的基因或供体生物体的基因组已经被充分研究,它可以存在于基因库中。如果DNA序列已知,但没有该基因的拷贝可用,则可以人工合成。
要插入遗传修饰的生物体中的基因必须与其它遗传元件组合以使其正常工作。还可以在该阶段修饰基因以更好地表达或有效性。除了要插入的基因之外,大多数构建体含有启动子和终止子区以及选择标记基因。启动子区启动基因的转录,并且可以用于控制基因表达的位置和水平,而终止子区终止转录。 在大多数情况下赋予其在其中表达的生物体抗生素抗性的选择性标记,需要确定哪些细胞用新基因转化。
构建基因表达载体
DNA的分子链被切开后,还得缝合起来以完成基因的拼接。1967年,科学家们在5个实验室里几乎同时发现并提取出一种酶,这种酶可以将两个DNA片段连接起来,修复好DNA链的断裂口。1974年以后科学界正式肯定了这一发现,并把这种酶叫作DNA连接酶。从此,DNA连接酶就成了名符其实的“缝合”基因的“分子针线”。只要在用同一种“分子剪刀”剪切的两种DNA碎片中加上“分子针线”,就会把两种DNA片段重新连接起来。
质粒载体
DNA的操作通常发生在质粒内。使用重组DNA技术,例如限制性消化,连接和分子克隆制备构建体。 其中一种常见的技术是将新的遗传物质插入宿主基因组中的特定位置,或在所需的能够敲除的基因组位点产生突变内源基因。基因靶向技术使用同源重组来靶向特定内源基因的期望变化。这在植物和动物中发生的频率相对较低,并且通常需要使用选择标记基因。使用工程化核酸酶如锌指核酸酶,工程改造的归巢核酸内切酶(或“兆碱基”)或由TAL效应物产生的核酸酶,可以增强基因靶向的频率。 除了增强基因靶向,工程化核酸酶也可以用于在产生基因敲除的内源基因中引入突变。
病毒载体
病毒载体是一种常用的工具,可将遗传物质带入细胞。可发生于完整活体或是细胞培养中。原理是利用病毒具有传送其基因组进入其他细胞,进行感染的分子机制。
慢病毒载体是病毒载体中的一种在慢病毒基础上发展起来的基因工程载体。慢病毒基因组不需要靶细胞分裂即可整合到细胞核中。来源于慢病毒的载体也体现了能够稳定地转导分裂和非分裂细胞(包括干细胞)这一优势。慢病毒载体目前已发展成为一个强大的基因转移工具,广泛应用于生物学研究和基因治疗。慢病毒载体构建时,病毒的顺式作用元件(非编码所需的转录、反转录和包装元素)必须与反式作用元件(酶、结构和辅助蛋白编码)序列分离,以防止形成具有复制能力的慢病毒颗粒(RCL)。
将目的基因导入受体细胞
只有约1%的细菌天然能够摄取外源DNA。然而,这种能力可以通过外部刺激(例如热或电击)诱导其他细菌产生,增加其细胞膜对DNA的通透性;已吸收的DNA可以与基因组整合或作为染色体外DNA(如质粒)存在。 DNA通常使用显微注射插入动物细胞,其中它可以通过细胞的核膜直接注射到细胞核中或通过使用病毒载体。在植物中,通常使用农杆菌介导的重组或基因枪技术(biolistics)插入DNA。
在农杆菌介导的重组中,质粒构建体含有T-DNA,其负责将DNA插入宿主植物基因组中。在感染植物细胞之前,将该质粒转化到不含质粒的农杆菌中。然后农杆菌将天然地将遗传物质插入植物细胞中。在生物动力学中,金或钨的颗粒用DNA包被,然后注射到愈伤组织细胞或植物胚胎中。一些遗传物质将进入细胞并转化它们。该方法可以用于不易受农杆菌感染的植物上,并且还允许植物质体的转化。用于植物和动物细胞的另一种转化方法是电穿孔。电穿孔包括使植物或动物细胞遭受电击,其可使细胞膜对质粒DNA可透过,在一些情况下,电穿孔细胞可将DNA掺入其基因组中。由于其对细胞和DNA的损害,基因枪和电穿孔的转化效率低于农杆菌介导的转化和显微注射。
由于用于转化的细胞通常只有一个,因此必须将该单个细胞培育成生物体。细菌由单个细胞组成并且不需要克隆再生。在植物中,这通过使用组织培养来实现。每种植物对通过组织培养成功再生具有不同的要求。如果成功,则产生在每个细胞中含有遗传修饰的成年植物。在动物中,有必要确保插入的DNA存在于胚胎干细胞中。
目的基因的检测与鉴定
选择标记用于区分转化的和未转化的细胞。这些标记通常存在于遗传修饰生物体中,尽管已经开发了可以从成熟遗传修饰植物中除去选择性标记的多种策略。 当产生后代时,可以筛选基因的存在。来自第一代的所有后代对于插入的基因将是杂合的,并且必须交配在一起以产生纯合动物。
进一步的测试使用PCR,南方墨点法(Southern印迹),并且进行DNA测序以确认生物体含有新基因。即将遗传修饰生物的基因组DNA提取出来,在含有目的基因的DNA片段上用放射性同位素等做标记,以此作为探针,使探针与基因组DNA杂交,如果显示出杂交带,就表明目的基因已插入染色体DNA中。该方法因发现者而命名为南方墨点法。这些测试还可以确认插入基因的染色体位置和拷贝数。基因的存在并不保证其在靶组织中以适当的水平表达,因此也使用寻找和测量基因产物(RNA和蛋白质)的方法。这些包括北方墨点法(Northern印迹),定量即時聚合酶鏈鎖反應(RT-PCR),西方墨点法,免疫荧光,酵素免疫分析法(ELISA)和表型分析。为了稳定转化,该基因应以孟德尔遗传模式传递给后代,因此也应研究该生物的子代。
应用及成果
基因工程在医学、研究、工业和农业中的都有所应用,并且可以广泛应用于植物、动物和微生物。
医学
在医学中,基因工程已经用于制造药物,创建模型动物,进行实验室研究和基因治疗。
生产
遗传工程用于大规模生产胰岛素、生长激素、follistim(用于治疗不育)、人白蛋白、单克隆抗体、凝血因子、疫苗和许多其他药物。小鼠杂交瘤,融合在一起以产生单克隆抗体的细胞已经通过基因工程人源化以产生人单克隆抗体。正在开发遗传工程改造的病毒,其仍然可以赋予免疫性,但缺乏感染序列。
研究
基因工程用于创建人类疾病的动物模型。遗传修饰小鼠是最常见的基因工程动物模型。它们已用於癌症、肥胖、心脏病、糖尿病、关节炎、药物成瘾、焦虑、衰老、帕金森病的研究和模拟。可以针对这些小鼠模型测试潜在的疗法。在增加器官移植成功率方面,培育了遗传修饰猪。
基因治疗
基因治疗是人类的遗传工程,通常通过用有效基因替代有缺陷的基因。这可以发生在体细胞组织或种系组织中。
体细胞基因治疗
体细胞基因治疗已针对多种疾病进行了临床研究,包括X连锁严重复合型免疫缺乏症,慢性淋巴细胞性白血病(CLL),和帕金森病 2012年,Glybera成为第一个得到欧洲或美国批准,可在欧洲委员会批准后獲准用于临床使用的基因治疗药物。
种系基因治疗
关于种系基因治疗,科学界一直反对使用生物技术以可遗传的方式改变人类基因的尝试,因为该技术才刚刚起步。随着技术的发展、CRISPR等新技术的出现,2015年3月,科学家们敦促世界范围内禁止临床使用基因编辑技术以可遗传的方式编辑人类基因组。2015年4月,中国研究人员报告了基础研究实验的结果引发了争议,在这些实验中,他们使用CRISPR编辑了不可发育的人类胚胎的DNA 2015年12月,世界主要科学院的科学家们呼吁暂停进行可遗传的人类基因组编辑,包括与CRISPR-Cas9技术相关的那些。
如果技术不仅用于治疗,而且用于增强、修改或改变人的外表、适应性、智力、性格或行为,也存在伦理问题。固化和强化之间的区别也很难界定。 超人主义者认为人类的增强是可取的。
科研
遗传工程是科学家的重要工具。来自各种生物的基因和其他遗传信息转化为细菌,以供储存和修饰,遗传修饰的细菌在该过程中产生。使用细菌的原因是其廉价易得,生长、克隆繁殖迅速,相对容易转化,而且可以长期保存,在-80℃几乎可以无限期储存。分离後的基因可以储存在细菌中,可无限增殖供给研究。
可以将生物体遗传工程化以发现某些基因的功能。这可能是对生物表型的影响,其中表达基因或与其相互作用的其它基因。这些实验通常涉及功能丧失,功能获得,跟踪和表达。
功能缺失实验
例如在基因敲除实验中,遗传修饰生物会缺少一个或多个基因的活性。敲除实验涉及体外构建和操作DNA构建体,其在简单敲除中由所需基因的拷贝组成,或将其改变为无功能的。胚胎干细胞掺入改变的基因、替换已经存在的功能性拷贝。将这些干细胞注射到胚泡中,植入以替代亲代遗传物质。实验者藉此分析由该突变引起的缺陷,从而确定特定基因的作用。这项操作在发育生物学中使用频繁。在黑腹果蝇等生物体中另一种可行的方法是在大群体中诱导突变,然后筛选后代以获得所需的突变。类似的方法可以用于植物和原核生物中。功能丧失可说明某种蛋白质是否是某项功能所必需的,而非说明某种蛋白质具有某项功能。特别是如果功能需要多个蛋白质,那么只要缺少其中一个就会丧失这项功能。
基因导入实验
与敲除实验的思路相对。这些有时与敲除实验一起进行以更精细地了解所需基因的功能。该过程与敲除工程中的操作大体相同,除了將构建体设计成可增加基因的功能,通常通过提供额外的基因拷贝或更频繁地诱导蛋白质的合成。基因导入用于判断蛋白质是否足够用于功能,但并不总是意味着它是必需的,特别是当处理遗传或功能冗余时。
基因靶向实验
寻求获得特定蛋白质的位置和相互作用的信息。一种实现方法是用“融合”基因替换野生型基因,该融合基因是野生型基因与标记基因如绿色荧光蛋白(GFP)的并置,这使得产物的遗传修饰可见。虽然这是一个有用的技术,但是其操作可能破坏基因的功能,产生二次效应,可能会产生可疑的实验结果。更复杂的技术现在正在开发中,用以跟踪蛋白质产物而不减轻其功能,例如添加将作为单克隆抗体的结合基序的小序列。
表达实验
表达实验旨在发现特定蛋白质在何处和何时产生。在这些实验中,将编码蛋白质的DNA(称为基因的启动子)之前的DNA序列重新引入生物体中,其中蛋白质编码区由报告基因(例如GFP)或催化染料产生的酶所取代。因此,可以观察到产生特定蛋白质的时间和地点。表达研究可以进一步通过改变启动子来发现哪些片段对于基因的正确表达至关重要,且实际上由转录因子蛋白结合;这个过程称为启动子敲击。
工业
使用基因工程技术,可以用编码有用蛋白质例如酶的基因转化制造微生物(例如细菌或酵母),或转化来自多细胞生物体(例如昆虫或哺乳动物的细胞),经过转化的生物体将过表达所需的蛋白。通过使用发酵工程技术在生物反应器设备中生长转化的生物体,然后纯化蛋白质,可以制备大量的蛋白质。 一些基因在细菌中不能良好地作用,因此也可以使用酵母菌、昆虫或哺乳动物等真核生物细胞。这些技术用于生产药物、补充剂(如色氨酸),帮助生产食物(乳酪制造中的凝乳酶)和燃料。其它與研究中之遗传修饰细菌有所相關的应用,包括使细菌在其自然循环外进行任务,例如制造生物燃料,清理溢油,碳和其他有毒废物,以及检测饮用水中的砷。某些遗传修饰的微生物也可以用于生物矿化和生物修复,因为它们能够从其环境中提取重金属并将其掺入更易于回收的化合物中。
实验室中的应用
在材料科学中,基因修饰的病毒已经在学术实验室中用作组装更环保的锂离子电池的支架。
通过在某些环境条件下表达荧光蛋白,细菌已被設計为传感器之用。
农业
基因工程最有名和有争议的应用之一是创造和使用遗传修饰作物或遗传修饰生物,如萤光鱼,用于生产遗传修饰食品和具有多种用途的材料。
遗传修饰食品作物的生产有四个主要目标,即:耐病虫害、提高作物价值、制造副产品和加快生长强化植株。
环境保护
遗传工程在保护和自然区域管理中具有潜在的应用。例如,已经提出通过病毒载体的基因转移作为控制入侵物种以及接种来自疾病的受威胁动物群的手段。还提出了遗传修饰树作为赋予野生种群群体免疫的方法。随着气候变化和其他扰动导致生物体适应不良的风险增加,通过基因调整促进适应可能是减少灭绝风险的一个解决方案。遗传工程在保护中的应用迄今为止大部分是理论上的,还没有付诸实践。将需要进一步的实验来衡量这种做法的好处和成本。
技术限制
遗传工程的管理调控涉及政府为评估和管理与遗传修饰作物的开发和销售相关的风险而采取的措施。不同国家和地区针对遗传修饰作物的管理存在差异,其中美国和欧洲之间的差异最明显。根据基因工程产品的预期用途,在各国家的法规有所不同。例如,非食品用途的作物通常不由负责食品安全的机构审查。从20世纪80年代后期开始,评估包括粮农组织和世卫组织在内的组织在遗传修饰植物和食品安全方面的指导。
争议
批评者反对使用基因工程本身有几个理由,包括伦理问题,生态问题,与传统及有机农业的商业利益冲突,以及由于遗传修饰技术和遗传修饰生物体受知识产权法律的限制所引起的经济关注。遗传修饰生物也参与关于遗传修饰食品的争议,涉及遗传修饰作物生产的食品是否安全 ,是否应该贴标签,以及是否需要遗传修饰作物来满足世界粮食需求。这些争议导致诉讼,国际贸易争端和抗议,以及在一些国家限制商业产品的监管。
注释
参见
外部連結
| 维基共享资源中相关的多媒体资源:基因工程 |
| 维基语录上的基因工程语录 |
| 關於基因工程 的圖書館資源 |
- GMO Safety - Information about research projects on the biological safety of genetically modified plants.
- GMO-compass, news on GMO en EU
| ||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|