钋
釙(拼音:pō,注音:ㄆㄛˋ;英語:Polonium),是一種化學元素,其化學符號为Po,原子序數为84。釙是一種稀有且具有高度放射性的銀白色金屬(有時歸為類金屬)。在1898年由玛丽亚·居里和皮埃尔·居里所發現,並以玛丽亚·居里的故鄉波蘭(Polska)命名。
釙的化學性質近似於同族的硒與碲,然而,其金屬性則和同週期的相鄰元素鉈、鉛與鉍較為相似。釙沒有穩定的同位素,其所有天然同位素的半衰期都很短,因此釙在自然界僅極為少量地以238U的衰變產物──210Po(半衰期為138天)的形式存在於鈾礦之中。儘管有半衰期略長於210Po的同位素存在,但這些同位素只能以人工合成的方式生成。在現今,釙主要是以中子照射鉍元素的方式,在毫克等級的數量下,極少量地製造。由於其強烈放射性所導致的化學鍵輻解及衰变热,絕大多數有關釙化學的研究僅在極微量的尺度下進行。
釙有若干和其放射性有關的應用:包括作為防靜電裝置、中子源、α粒子源、以及毒物。
目录
性质
210Po会α衰变,半衰期138.4天,衰变产物为稳定的206Pb。一毫克(5居里)210Po每秒放出的α粒子相当于五克226Ra每秒放出的α粒子。几居里(1居里等于3.7×1010 贝克勒尔,1 Ci = 37 GBq)的210Po会电离周围的空气,产生蓝色辉光。
大约有十万分之一的α衰变会激发原子核,导致发射最大能量为803 keV的γ射线。
结构
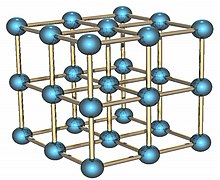
钋是有两种同素异形体。α相的钋是唯一一种在标准情况下呈简单立方结构的元素,边长为335.2皮米;β相则呈菱面体结构。钋的结构已被X光衍射和电子衍射确认。
210Po有挥发性。虽然钋的熔点为254 °C(489 °F),沸点更是高达962 °C(1,764 °F),但如果把钋加热到55 °C(131 °F),一半的钋就会在45小时内气化成双原子分子Po2。关于钋如何做到这一点存在多种假设,其中一种称小簇钋原子通过α衰变散裂。
物理性质
钋在氧族元素中是典型的金属,和硒、碲一样,有挥发性。钋在449.85℃下的蒸汽压约为13Pa,易升华或蒸馏。钋的物理性质,尤其是高熔点、高沸点,和同周期的铊、铅、铋相似,而与上方的碲差别较大。这种横向的相似性不能延伸到化学性质上。
化学性质
钋的化学性质类似碲,但和邻居铋也有一些相似之处。钋易溶于稀酸,微溶于碱。钋的溶液首先因为Po2+离子而呈粉红色,但随后因为钋的α衰变使溶剂电离,并将Po2+氧化为Po4+而迅速变黄。由于钋在衰变后也会释放出α粒子,因此这个过程伴随着实验室玻璃器皿由于吸收了α粒子而产生气泡、热和光的发射。因此,钋溶液易挥发,除非密封,否则会在几天内蒸发。pH值约为1时,钋离子很容易水解,被酸(例如草酸、柠檬酸和酒石酸)络合。钋不和硫直接反应。
化合物
钋有超过50种化合物,其中最稳定的是钋化物,可以由钋和金属直接反应而成。Na2Po为反萤石结构,钋化钙、钋化钡、钋化汞、钋化铅和镧系元素钋化物为NaCl结构;BePo和CdPo为纤维锌矿结构;MgPo则有砷化镍结构。大部分钋化物在600 °C分解,除了~300 °C下分解的HgPo和在1000 °C以上熔化的镧系元素钋化物。如1250 °C下熔化的PrPo和2200 °C下熔化的TmPo。PbPo是非常罕见的天然钋化合物,由钋α衰变成铅而成。
钋化氢(PoH
2)是一种室温下易分解的挥发性液体,热力学上不稳定。水是另外一种在室温下为液体的氧族元素氢化物,但那是由于氢键导致的。钋有三种氧化物PoO、PoO2和PoO3,由钋被氧化而成。
钋能形成PoX2、PoX4和PoF6等卤化物。它们可溶于对应的氢卤酸,如PoClx可溶于HCl、PoBrx可溶于HBr、而PoI4可溶于HI。二氯化钋可由PoCl4被SO2还原而成,而室温下PoBr4被H2S还原可以得到二溴化钋。四卤化物可由二氧化钋和对应的氢卤酸反应而成。
其它钋化合物包括亚钋酸钾,各种亚钋酸盐和钋酸盐,乙酸钋、溴酸钋、碳酸钋、柠檬酸钋、铬酸钋、氰化钋、甲酸钋、钋(II)和钋(IV)的氢氧化物、四硝酸钋、硒酸钋、亚硒酸钋、一硫化钋、硫酸钋、焦硫酸钋和亚硫酸钋。
一些有机钋化合物是已知的,大多为钋醚(R2Po),卤化三芳基钋(Ar3PoX)和二卤化而芳基钋(Ar2PoX2)。钋还与某些螯合剂,例如2,3-丁二醇和硫脲形成可溶性化合物。
| 化学式 | 颜色 | 熔点(°C) | 升华点(°C) | 晶体结构 | 皮尔逊符号 | 空间群 | No | a(pm) | b(pm) | c(pm) | Z | 密度(g/cm3) | 来源 |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| PoO | 黑色 | ||||||||||||
| PoO2 | 浅黄色 | 500(分解) | 885 | 面心立方晶系 | cF12 | Fm3m | 225 | 563.7 | 563.7 | 563.7 | 4 | 8.94 | |
| PoH2 | -35.5 | ||||||||||||
| PoCl2 | 深红宝石色 | 355 | 130 | 正交晶系 | oP3 | Pmmm | 47 | 367 | 435 | 450 | 1 | 6.47 | |
| PoBr2 | 紫棕色 | 270(分解) | |||||||||||
| PoCl4 | 黄色 | 300 | 200 | 单斜晶系 | |||||||||
| PoBr4 | 红色 | 330(分解) | 面心立方晶系 | cF100 | Fm3m | 225 | 560 | 560 | 560 | 4 | |||
| PoI4 | 黑色 |
同位素
钋有42种已知的同位素,全部都有放射性。它们的質量數在186到227之间。其中有8種作為衰变产物存在於自然界中,當中以210Po(半衰期138.376天)壽命最長,且分布最為广泛,可通过天然铋發生中子捕获而形成。半衰期更长的209Po(半衰期7002125200000000000♠125.2±3.3年)和208Po(半衰期2.9年)不存在於自然界中,只能通过回旋加速器,用α粒子、质子或氘核轰击铅或铋而成。
历史
钋是由玛丽·居里和皮埃尔·居里在1898年7月发现的,,暂定名为镭F,并以瑪麗·居禮的故乡波兰(拉丁語:Polonia)命名。当时的波兰在俄罗斯帝国、德意志帝国和奥匈帝国的瓜分之下,并没有作为一个独立的国家存在。居里夫人希望以她的故乡命名该元素,宣传其缺乏独立性。钋可能是第一个被命名以突出政治争议的元素。
这种元素是居里夫妇在调查沥青铀矿有放射性的原因时发现的第一个元素。在去除放射性元素铀和钍之后,沥青铀矿的放射性比铀和钍的总和还要高。这促使居里夫妇寻找更多的放射性元素。他们于1898年7月首次从沥青铀矿中分离出钋,五个月后,他们也分离出了镭。德国科学家维利·马克瓦尔德于1902年成功分离出3毫克钋,尽管当时他认为这是一种新元素,称之为“放射性碲”。“放射性碲”直到1905年才被证明是钋。
在美国,钋是在第二次世界大战期间作为曼哈顿计划的代顿计划的一部分生产的。钋和铍是核弹球形弹芯中心的调制中子引爆器的关键成分。调制中子引爆器在瞬发临界状态时启动了链式反应,以确保武器不会过早临界。调制中子引爆器用于早期的美国武器,随后的美国武器出于同样的目的使用了脉冲中子产生器。
直到战后,钋的大部分基本物理学性质都是国家机密。它被用作引发剂这一事实直到1960年代才被解密。
美国原子能委员会和曼哈顿计划资助了在罗切斯特大学的人体实验。他们在1943年至1947年间对五个人的身上使用钋。这些人们被管理在9和22微居里(330和810千貝克) 的钋里,以研究其排泄。
存在和制备
钋在自然界中是一种非常稀有的元素,因为其所有天然同位素的壽命都很短。钋有七种同位素以衰变产物在地殼中痕量存在:210Po、214Po和 218Po存在于铀衰变链,211Po 和215Po 存在于錒衰變鏈,而212Po 和216Po 则存在于钍衰变链。在这些钋的同位素中,只有210Po 的半衰期超过3分钟。
钋可以在铀矿石中找到,每公吨铀矿中大约有0.1毫克钋(1010分之一),約為镭含量的 0.2%。地壳中的钋含量是无害的。人们已在使用磷酸盐肥料种植的烟叶的烟草烟雾中发现钋。
因为它的浓度很低,所以从天然来源中分离钋是一个乏味的过程,並不實際。在20世纪上半叶进行的有史以来最大的钋元素提取仅得到 40 Ci(1.5 TBq)(9毫克)钋-210,它们是通过加工37吨镭生产的残余物而获得的。现在通常通过用高能中子或质子照射铋来获得钋。
1934年,一项实验显示天然的209Bi被中子轰击会产生210Bi,然后β衰变成210Po。最终的纯化是通过高温化学完成的,然后是液-液萃取技术。钋现在可以在这个过程中以毫克量级制造,该过程使用了核反应堆中的高中子通量。每年仅生产约100克的钋,几乎全部都在俄罗斯生产,这使得钋极为稀有。
该过程可能会导致基于鉛鉍合金液态金属冷却反应堆的问题,例如用于苏联海军的苏联潜艇K-27。人们必须在这些反应堆中采取措施来处理从冷却剂中释放出来的 210Po ,以避免不希望出现的可能性。
较长寿的钋同位素208Po和209Po可以由质子或氘核通过回旋加速器轰击到铋上而成。其它中子更少,更不稳定的同位素可以由铂被碳核轰击而成。
应用
作为α粒子的来源的钋是在前苏联生产的。此类来源用于通过衰减的α辐射测量工业涂层的厚度。
由于强烈的α辐射,一克 210Po 样品会自发加热到500 °C(932 °F)以上,产生大约140瓦的功率。因此,210Po 用作原子热源,通过热电效应材料为放射性同位素热电机提供动力。举个例子,210Po 热源用于月面步行者1号(1970)和月面步行者2号(1973)这两个月球漫游车,以在月球夜晚保持其内部组件温暖。它也用于宇宙号84和其它90颗人造卫星(1965)。
使用氧化铍可以将钋发射的α粒子转化为中子,转化率为每一百万个α粒子变成93个中子。因此,Po-BeO 混合物或合金可用作中子源,例如,用于核武器的调制中子引爆器中,也用于油井的检查。苏联每年使用大约1500个这类中子源,其中单个中子源的活动为 1,850 Ci(68 TBq)。
钋也是刷子或更复杂的工具的一部分,用于在涂装之前消除照相板、纺织工厂、纸卷、塑料片和基材(如汽车)上的静电。钋发射的阿尔法粒子电离空气分子,从而中和附近表面的电荷。一些防静电刷包含多达500微居里(20百萬貝克)的210Po来作为带电粒子的来源,用于中和静电。在美国,每单位不超过 500 µCi(19 MBq) 的(密封)210Po 的设备可以根据“通用许可证”以任意数量购买,这意味着买家不需要由任何机构注册。钋的半衰期很短,几乎每年都需要在这些设备中更换;它也具有高放射性,因此大部分已被不太危险的β粒子源所取代。
有时,会在实验室和教学中会使用少量的 210Po——它们通常的数量级为4-40 kBq(0.11-1.08 µCi)。钋以密封源的形式沉积在基材上或树脂或聚合物基质中——通常無需NRC或类似机构的许可,因为它们不被认为是危险的。少量的 210Po 在美国会作为实验室实验的“针源”出售给公众,并由科学供应公司进行零售。钋有一层镀层,镀层又镀上一层金等材料,它允许α辐射(用于云室等实验)通过,同时防止钋被释放并作为有毒物质。根据鲍勃·拉扎尔,他们通常每年销售四到八个这样的钋源。
生物作用和毒性
概述
钋可能有害,且没有生物学作用。钋没有有毒的化学性质,其毒性主要源自其高度的放射性。依质量计,钋-210的毒性是氢氰酸的25万倍(相较于氢氰酸的250毫克,210Po对成年人(见下)的LD50低于1微克)。钋的主要危害是其强烈的放射性(作为α粒子发射体),这使其难以安全处理。就算是微克量级,处理210Po 也非常危险,需要专门的设备(配备高性能过滤器的负压的α手套箱)、充分的监控和严格的处理程序,以避免任何污染。钋释放的 α 粒子在摄入、吸入或吸收时很容易损伤有机组织,尽管它们不会穿透表皮,因此只要钋在体外,就不会对身体造成危害。佩戴耐化学腐蚀且完好无损的手套是避免钋直接通过皮肤经皮扩散的强制性预防措施。以浓硝酸形式输送的钋很容易通过不合适的手套(例如乳胶手套)扩散,否则酸可能会损坏手套。
据报道,一些微生物可以通过甲钴胺甲基化钋。这类似于汞、硒和碲在生物中被甲基化以产生有机金属化合物的方式。对大鼠体内钋- 210代谢的研究表明,摄入的钋-210 只有0.002%至0.009%以挥发性的钋-210的形式排出体外。
急性影响
急性辐射暴露的半数致死量(LD50)约为 4.5 Sv。 通过摄入的 210Po 的待积有效剂量当量为0.51 µSv/Bq,吸入则为2.5 µSv/Bq。摄入 8.8 MBq(240 µCi),或约50 纳克(ng)的钋;或是吸入1.8 MBq(49 µCi)或约 10 ng的钋可导致致死量 4.5 Sv。一克210Po 理论上可以使2000万人中毒,其中有1000万人死去。210Po 的实际毒性低于这些估计值,因为辐射暴露分布在数周内(钋在人体中的生物半衰期为30至50天)比瞬时剂量的破坏性要小一些。据估计,210Po 的半数致死量为 15百萬貝克(0.41毫居里),即0.089微克 (μg),致死量仍然极低。作为比较,一粒食盐的重量为 0.06 mg = 60 μg。
长期影响
除了急性影响之外,辐射暴露(内部和外部)会带来每西弗 5-10% 的长期癌症死亡风险。普通人群在室内空气中以氡子体的形式暴露于少量的钋,同位素 214Po 和 218Po 被认为是造成美国每年估计 15,000-22,000 例肺癌死亡的主要原因,这些死亡归因于室内的氡。吸烟也会导致额外的钋暴露。
监管暴露限制和处理
摄入的 210Po 的最大允许身体负担仅为 1.1 kBq(30 nCi),这相当于一个仅重6.8皮克的钋粒。空气中210Po的最大允许工作场所浓度约为 10 Bq/m3(6990300000000000000♠3×10−10 µCi/cm3)。人体中钋集中的器官是脾脏和肝脏。由于脾脏(150 克)和肝脏(1.3 至 3 公斤)比身体其他部位小得多,如果钋集中在这些重要器官中,对生命的威胁比均匀地分布在整个身体中还高,这与铯和氚(以 T2O)相同。
210Po广泛用于工业,并且易于获得,几乎没有监管或限制。在美国,2007年实施了由核管理委员会运行的跟踪系统,以登记购买超过 16居里(590吉貝克) 的钋-210(5000倍致命剂量)。国际原子能机构据说正在考虑更严格的规定,有传言说可能会将钋报告要求收紧10倍,变成1.6居里(59吉貝克)。
钋及其化合物必须在手套箱中进行处理,该箱被进一步封闭在另一个箱中,保持比手套箱略高的压力,以防止放射性物质泄漏。由天然橡胶制成的手套不能提供足够的防辐射保护,手术手套是必要的。氯丁橡胶手套比天然橡胶可以更好地屏蔽辐射。
中毒案例
尽管该元素高度危险,但发生钋中毒的情况很少见。它在自然界中极度稀有、所有同位素的半衰期都很短、获得大量同位素所需的专业设施和设备以及针对实验室事故的安全预防措施都使有害暴露事件不太可能发生。因此,只有少数具体归因于钋暴露的辐射中毒案例得到证实。
20世纪
为了回应对职业性钋暴露风险的担忧,1944年至1947年间罗切斯特大学的五名人类志愿者接受了 210Po,以研究其生物学行为。这些研究由曼哈顿计划和AEC资助。研究有四男一女参加,都患有晚期癌症,年龄在三十出头到四十出头之间。之所以选择这些人,是因为实验者想要没有因工作或意外而接触过钋的受试者。210Po注射到4名住院患者中,并口服给予第5名患者。钋的给药剂量(均在 0.17-0.30 μCi kg-1的范围内)均未达到致死量。
1954年7月10日,苏联首次记录到直接由钋中毒导致的死亡。一名身份不明的41岁男子于6月29日就医,呕吐和发烧严重;在前一天,他在一个区域工作了五个小时,当时他并不知道,一个装有 210Po 的胶囊已经减压并开始以气溶胶的形式分散。在此期间,他摄入的空气中的 210Po 的总量估计约为0.11GBq(几乎是半数致死量4.5 MBq的25倍)。尽管接受了治疗,但他的病情继续恶化,并在暴露事件后13天死亡。
有人认为,伊雷娜·约里奥-居里1956年死于白血病是由于钋的辐射导致的。1946年,当她的实验室工作台上的密封胶囊爆炸时,她意外暴露在外。
同样的,在1957年至1969年期间,以色列发生的几起死亡事件据称是由 210Po 暴露引起的。1957年,魏茨曼研究所的实验室发现泄漏。人们在研究放射性材料的物理学家Dror Sadeh教授的手上发现了 210Po 的痕迹。医学测试表明没有伤害,但这些测试不包括骨髓测试。在接下来的几年里,他的一名学生Sadeh和两名同事死于各种癌症。这个问题被秘密调查,但从未正式承认泄漏与死亡之间存在联系。
21世纪
亚历山大·瓦尔杰洛维奇·利特维年科是2001年叛逃到英国的前俄罗斯联邦安全局特工,在2006年死亡的原因被确定为致死剂量的210Po导致的中毒,随后确定这些 210Po 可能是由两名俄罗斯前安全人员安德烈·卢戈沃伊和Dmitry Kovtun故意下毒的。 因此,利特维年科的死是第一个(也是迄今为止唯一一个)证实钋的极端毒性被恶意使用的实例。
2011 年,一项指控浮出水面,即巴勒斯坦国领导人亚西尔·阿拉法特于2004年11月11日因不明原因死亡,也是蓄意钋中毒所致,2012年7月,瑞士洛桑放射物理研究所在阿拉法特的衣服和个人物品中检测到异常高浓度的 210Po。然而,该研究所的发言人强调,尽管进行了这些测试,阿拉法特的医疗报告与210Po中毒不一致,而科学记者Deborah Blum认为烟草烟雾的影响可能更重要,因为阿拉法特和他的许多同事都是重度吸烟者。法国和俄罗斯团队随后的测试确定,210Po 水平升高不是故意下毒的结果,也没有导致阿拉法特死亡。
治疗
有人提出使用螯合剂,如二巯基丙醇可以净化人体。 在一项实验中,大鼠得到致死量 1.45 MBq/kg (8.7 ng/kg) 的210Po,所有未治疗的大鼠都在44天内死去,但用螯合剂HOETTTC 治疗后,有90%的大鼠存活了5个月。
生物标本中的检测
钋-210可以通过α粒子光谱法在生物样本中进行量化,以确认住院患者的中毒诊断或在法医学死亡调查中提供证据。由于背景辐射,健康人尿的钋-210排泄量通常在 5-15 mBq/天的范围内。超过 30 mBq/天的钋水平表明过度暴露于放射性核素。
在人类和生物圈中的存在
因为它位于铀衰变链,钋-210广泛存在于生物圈,包括人体组织中。地壳中的天然铀-238通过一系列固体放射性中间体衰变,包括镭-226至放射性惰性气体氡-222,其中一些氡在其3.8天的半衰期里会扩散到大气中。在那里,它通过几个步骤衰变成钋-210,其中大部分在其138天的半衰期被冲回地球表面,从而进入生物圈,最终衰变为稳定的铅-206。
早在 1920 年代,法国生物学家Antoine Lacassagne 使用他的同事居里夫人提供的钋,表明该元素在兔子组织中具有特定的吸收模式,特别是在肝脏、肾脏和睾丸这些地方的钋浓度很高。最近的证据表明,这种行为是由于钋取代了含硫氨基酸或相关分子中的氧族元素同类硫所致,并且在人体组织中有类似的分布模式。钋确实是一种天然存在于所有人类中的元素,对自然背景辐射的剂量有显着影响,具有广泛的地理和文化差异,例如在北极居民中的钋含量尤其的高。
烟草
烟草中的钋-210导致了全世界许多的肺癌病例。大多数的钋来自大气中沉积在烟叶上的铅-210,铅-210是氡-222气体的衰变产物,其中大部分似乎源自施用于烟草土壤的肥料中的镭-226衰变。
自1960年代初以来,人们就知道烟草烟雾中存在钋。世界上一些最大的烟草公司在40年的时间里研究了去除这种物质的方法——但无济于事。研究结果从未发表。
食物
钋存在于食物链中,尤其是在海鲜中。
參考文獻
外部連結
- 元素钋在洛斯阿拉莫斯国家实验室的介紹(英文)
- EnvironmentalChemistry.com —— 钋(英文)
- 元素钋在The Periodic Table of Videos(諾丁漢大學)的介紹(英文)
- 元素钋在Peter van der Krogt elements site的介紹(英文)
- WebElements.com – 钋(英文)
| 化學元素 | ||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
IA 1 |
IIA 2 |
IIIB 3 |
IVB 4 |
VB 5 |
VIB 6 |
VIIB 7 |
VIIIB 8 |
VIIIB 9 |
VIIIB 10 |
IB 11 |
IIB 12 |
IIIA 13 |
IVA 14 |
VA 15 |
VIA 16 |
VIIA 17 |
VIIIA 18 |
|||||||||||||||||||
| 1 | H | He | ||||||||||||||||||||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | ||||||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | ||||||||||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | ||||||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | ||||
| 7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | ||||
| ||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||
|