冠状病毒
| 冠状病毒 | |
|---|---|

| |
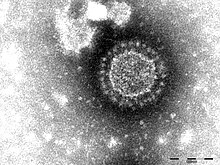
| 電子顯微鏡下的禽類傳染性支氣管炎病毒 | |

| |
| 冠狀病毒示意圖
紅色:刺突蛋白(S),又稱棘蛋白
灰色:包膜
黃色:包膜蛋白(E)
橙色:膜蛋白(M)
| |
|
病毒分類 | |
| –未分级–: | 病毒 Virus |
| 域: | 核糖病毒域 Riboviria |
| 界: | 正核糖病毒界 Orthornavirae |
| 门: | 小核糖病毒门 Pisuviricota |
| 纲: | 小南嵌套病毒纲 Pisoniviricetes |
| 目: | 網巢病毒目 Nidovirales |
| 科: | 冠状病毒科 Coronaviridae |
| 亚科: | 正冠状病毒亚科 Orthocoronavirinae |
| 屬 | |
| 異名 | |
| |
正冠狀病毒亞科(學名:Orthocoronavirinae)通称冠状病毒(拉丁文/英文:coronavirus),是一类可感染哺乳动物與鸟类的病毒,属于网巢病毒目冠状病毒科,為具有包膜的正單鏈RNA病毒。最早發現的冠狀病毒為1920年代感染雞隻的傳染性支氣管炎病毒(IBV),1960年代始發現造成人類普通感冒的冠狀病毒,而冠狀病毒之名則是在1968年發表,得名自其表面的棒狀突起(刺突)。
冠狀病毒的基因組大小介於26000與32000nt之間,是RNA病毒中基因組大小位居前列者,編碼刺突蛋白(S)又稱棘蛋白、包膜蛋白(E)、膜蛋白(M)和核殼蛋白(N)等四種結構蛋白、複製酶(ORF1a/b)與若干輔助蛋白;冠状病毒可利用自身合成的複製酶及蛋白酶,合成上述蛋白及其它非結構蛋白;部分冠狀病毒還能合成而具有血細胞凝集素酯酶(HE)。這些蛋白除維持病毒結構,還有促進感染與抵抗宿主免疫反應等功能。
刺突蛋白可與宿主細胞表面的受體結合,使病毒包膜和宿主細胞的膜融合以感染細胞。進入宿主細胞後,冠狀病毒會造成細胞內膜的重組,並在特化的膜結構中進行複製與轉錄,轉錄時會發生模板跳轉而產生許多長度不一的次基因組RNA,皆包含一或數個結構蛋白的基因,此跳轉可能是不同冠狀病毒間發生基因重組的機制。次基因組RNA與完整的mRNA皆可被轉譯成蛋白質,複製酶(ORF1a/b)在轉譯時會發生-1核糖體移碼而產生1a或1ab兩種多聚蛋白,可分別被自身的蛋白酶切割而形成14種非結構蛋白,參與病毒的轉錄與複製,其中一個非結構蛋白nsp14具有校對的功能,使冠狀病毒複製的準確度高於其他RNA病毒,可能是其得以維持較長基因組的原因。冠狀病毒的感染會影響細胞的許多訊息傳遞途徑,引發免疫反應,而病毒也有許多機制加以抵抗。
冠狀病毒依基因組成序列分為甲型、乙型、丙型與丁型等四個屬,其中甲型與乙型冠狀病毒為感染哺乳動物,其共祖可能是蝙蝠病毒,丙型與丁型冠狀病毒則以感染鳥類為主,其共祖應是鳥類病毒,而乙型冠狀病毒的Embecovirus亞屬可能是起源自感染鼠類的病毒,其中的鼠肝炎病毒為冠狀病毒研究的模式病毒,冠狀病毒的許多分子機制皆是通過研究此病毒而被闡明。
已知可感染人类的冠状病毒共有7种,其中有4種(人類冠狀病毒229E、人類冠狀病毒OC43、人類冠狀病毒NL63與人類冠狀病毒HKU1)可引发普通感冒,另外3種為導致嚴重疾病的严重急性呼吸道综合征冠状病毒(SARS-CoV)、中東呼吸症候群冠狀病毒(MERS-CoV)與严重急性呼吸系统综合征冠状病毒2(SARS-CoV-2),皆曾在全球各地造成疫情。此外還有許多冠狀病毒可感染家畜與家禽、寵物、實驗動物和野生動物,例如感染雞隻的禽冠狀病毒、感染豬隻的數種豬冠狀病毒、感染犬與貓的犬冠狀病毒和貓冠狀病毒、感染實驗小鼠與大鼠的鼠冠狀病毒。
目录
詞源
冠狀病毒的學名Coronavirus為最早研究人類冠狀病毒的英國病毒學家瓊·阿爾梅達和大衛·A·泰瑞爾所取,於1968年發表於《自然》的一篇文章。此名源於拉丁文的corona,意指「皇冠」或「花環」,這個詞本身則來自希臘文的κορώνη(korṓnē),意指「花環」。以Corona稱呼此類病毒的原因是在電子顯微鏡下觀察時,可見其病毒顆粒表面由刺突蛋白(spike protein)所構成、形似光暈的棒狀突起。
1971年,國際病毒命名委員會(現已改名為國際病毒分類委員會)將冠狀病毒(Coronavirus)接受為一屬名,隨著發現的病毒數量日益增多,該屬於2009年被細分成甲型冠狀病毒屬、乙型冠狀病毒屬、丙型冠狀病毒屬與丁型冠狀病毒屬等四個屬。
研究歷史
冠狀病毒感染動物最早的紀錄是1920年代晚期,美國飼養的雞隻出現急性呼吸道感染,1931年有科學家發表了對北達科他州雞隻呼吸道感染的詳細報告,指出被感染的小雞有喘氣與倦怠的症狀,且具有40%至90%的高死亡率。1933年造成此感染的病毒被成功分離,即傳染性支氣管炎病毒(IBV),1937年研究人員首度成功在實驗室培養此病毒。1940年代晚期有感染鼠類的冠狀病毒毒株被發現,即感染小鼠腦部的鼠肝炎病毒JHM株系(MHV-JHM),當時尚不知此病毒與IBV有關聯。
1960年代,感染人類的冠狀病毒漸被發現。1961年,大衛·A·泰瑞爾等英國醫學研究委員會感冒研究單位的研究人員發現了造成普通感冒的一新病毒株,將其命名為B814(此病毒株今已佚失),但用培養腺病毒與鼻病毒等其他感冒病毒的方法試圖培養該病毒時卻告失敗,後來使用由器官培養技術建立的人類胚胎氣管組織才成功培養此病毒。1962年又有科學家在芝加哥大學分離了新的感冒病毒毒株,於1966年發表,即為人類冠狀病毒229E。B814病毒與229E病毒皆能在自願的受試者中造成感冒,且經醚處理後即失去活性,顯示它們具有包膜。
1967年,倫敦聖湯瑪士醫院的病毒學家瓊·阿爾梅達和大衛·泰瑞爾合作,用電子顯微鏡觀察IBV、B814與229E等病毒的外形結構。同年美國國家衛生院的團隊發現了另一種造成感冒的新病毒株人類冠狀病毒OC43,此病毒株的表面亦具有棒狀突起,補體結合試驗結果顯示其與鼠肝炎病毒關係接近,於是這些病毒被合稱為「冠狀病毒」。此外也有許多感染其他動物的冠狀病毒被陸續發現,感染狗、貓、牛與豬的冠狀病毒都在20世紀後半葉被發現,並有許多相關研究發表。據病毒學家蘇珊·魏斯回憶,當時全世界研究冠狀病毒的科學家約只有數十人,大多研究鼠肝炎病毒,也有些人研究人類感冒病毒與家禽、家畜的冠狀病毒。
2000年後,冠狀病毒已造成三次嚴重的疫情爆發。2002年底,中华人民共和国广东省爆發了非典型肺炎,演變成為期近一年的SARS事件,疫情擴散至29個國家,超過8000人感染,其中774人死亡。此感染為新發現的冠狀病毒SARS-CoV造成,疑似是由市場中的果子貍傳染給人類,但後續研究顯示蝙蝠才是SARS病毒的自然宿主。2012年,沙烏地阿拉伯爆發了中東呼吸綜合症疫情,為另一新種冠狀病毒中東呼吸症候群冠狀病毒(MERS-CoV)造成,可能經駱駝傳染給人類,疫情隨後擴散至西亞其他國家與韓國,共有超過1000人感染,約400人死亡。2019年12月,新型冠狀病毒严重急性呼吸系统综合征冠状病毒2在中华人民共和国湖北省武汉市造成不明肺炎疫情,2020年初全球各地开始检测出此新型冠狀病毒,并判定为全球大流行,截至2023年3月10日,染病人數已逾6.76亿,超過688.1万人死亡。
2003年SARS疫情結束後,又有人類冠狀病毒NL63與人類冠狀病毒HKU1兩種造成普通感冒的冠狀病毒被發現。此外許多研究人員開始調查野生動物中的冠狀病毒,在世界各地的多種動物中發現不同的冠狀病毒,增進了人們對冠狀病毒在自然界中多樣性的了解。
病毒學
基因組
冠狀病毒的基因組為正單鏈RNA,基因組長度介於26000至32000nt之間,是RNA病毒中基因組最大的一類病毒之一,且與細胞生物的信使核糖核酸一樣具有5′端帽和3′端聚線苷酸尾,其基因組基本結構為5′非轉譯區(5'UTR)-複製酶(ORF1a/b)-刺突蛋白(S)-包膜蛋白(E)-膜蛋白(M)-核殼蛋白(N)-3′非轉譯區(3'UTR)-3′端聚線苷酸尾。編碼複製酶的開放閱讀框ORF1a/b占了基因組總長的2/3,可轉譯出一個多聚蛋白(polyprotein),此多聚蛋白有自我切割的活性,可自行切割成16個非結構蛋白(nsp1-nsp16)。基因組後方則是編碼S、E、M與N四種結構蛋白的開放閱讀框,其間可能穿插有其他編碼輔助蛋白的開放閱讀框,輔助蛋白開放閱讀框的種類、數目與位置均因病毒種類不同而異,多數並非病毒複製、感染所必須,但有些具有和病毒致病機理或抵抗宿主免疫反應相關的功能。
5′與3′非轉譯區
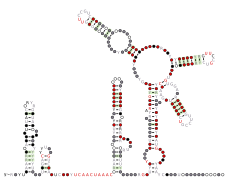
冠狀病毒基因組中的5′非轉譯區(5'UTR)與3′非轉譯區(3'UTR)均為病毒複製與轉錄所需,分別具有數個演化上保守的莖環。
5′非轉譯區(5'UTR)
冠狀病毒的5'UTR約長200-300nt,一般皆有莖環1(SL1)、莖環2(SL2)與莖環4(SL4),牛冠狀病毒、SARS相關冠狀病毒與一些丙型、丁型冠狀病毒在莖環2與莖環4中間還多了莖環3(SL3)。SL1除完全折疊的形式外,還可以基部未完全折疊的形式存在,與完全折疊者的比例達成一動態平衡,可能與基因組的其他區域有長距離交互作用,參與病毒的複製與轉錄;SL2是5'UTR的莖環中序列最保守的,可能也與病毒的複製與轉錄有關;SL3包含了TRS-L的序列;SL4是一個比較長的莖環,可分為4a與4b兩部分,中間為一個凸起區(bulge)分隔,許多冠狀病毒的SL4中有一個短的開放閱讀框,為一上游開放閱讀框(uORF),可抑制複製酶1ab的轉譯,實驗結果顯示SL4對突變的容忍度高,甚至將鼠冠狀病毒的SL4置換成不同的序列也不影響其複製(但若將其刪除則病毒無法存活),因而有假說認為其主要功能是冠狀病毒轉錄次基因組RNA(sgRNA)時用於定位,其基部結構較有彈性,可在sgRNA轉錄時和其互動,以幫助模板跳轉。
此外,許多冠狀病毒在SL4的下游還有另一莖環SL5,甲型與乙型冠狀病毒的SL5已超越5'UTR的範圍,包含部分複製酶ORF1a的序列,其中甲型冠狀病毒的序列較為保守,這兩屬的冠狀病毒SL5由SL5a、SL5b與SL5c等三個較小的莖環組成,三者頂部均有5'-UUCCG(U/C)-3'的序列,有學者認為可能是某些冠狀病毒組裝所需的包裝信號(packaging signal);丙型冠狀病毒也具有SL5,但結構與甲型、乙型病毒的稍有不同。SL5可能也參與病毒RNA的複製。
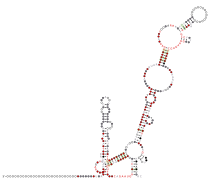
3′非轉譯區(3'UTR)
冠狀病毒的3'UTR約長300-500nt(不計3′端聚線苷酸尾)。乙型冠狀病毒3'UTR的5端(緊接在核殼蛋白基因的3端之後)為一凸起的莖環(bulged stem-loop;BSL),約長70nt,部分丙型冠狀病毒可能也有此結構,甲型冠狀病毒則無;甲型與乙型冠狀病毒BSL的下游有一個長54nt的假結結構(PK),可能為病毒複製所需,此區域的一個莖環(PK-SL2)頂部序列和BSL末端的序列配對而形成假結,甲型冠狀病毒因無BSL,PK-SL2是與上游的一個小型莖環配對形成假結。PK與BSL獨立存在或組成假節的比例為一動態平衡,以調控病毒負鏈RNA複製的起始,PK不與BSL形成假節時可能和基因組最3端的序列配對,複製起始時才因3端序列與一些非結構蛋白的結合而脫離,轉而和BSL形成假節,因而有分子開關的功能。
PK的下游為另一個較長、具有許多分支的莖環,因序列變異較大而被稱為多變區(hypervariable region;HVR),此莖環包含一個5′-GGAAGAGC-3′的保守序列(Oct),惟功能仍不明朗。
蛋白質
冠狀病毒的蛋白質可分為結構蛋白與非結構蛋白兩大類,前者包括包膜蛋白(E)、刺突蛋白(S)、膜蛋白(M)與核殼蛋白(N)等四種,部分病毒還具有血細胞凝集素酯酶(HE),皆為病毒顆粒的組成成分;後者則是由一多聚蛋白自我切割而成的15種蛋白,為病毒RNA複製與轉錄所需,有些非結構蛋白同時具有修飾病毒RNA或對抗宿主免疫反應的功能。除了結構蛋白與非結構蛋白外,許多冠狀病毒還有其他功能各異的輔助蛋白。
結構蛋白
冠狀病毒的外型大致呈球體,大小因種類而異,直徑一般介於80與120奈米之間,但也有小至50奈米與大至200奈米者,分子量約為40000kDa,具有包膜蛋白(E)、刺突蛋白(S)、膜蛋白(M)與核殼蛋白(N)等四種結構蛋白,外圍有脂雙層構成的包膜,在電子顯微鏡下為一電子密度高的殼狀結構,包膜蛋白、刺突蛋白與膜蛋白均位於包膜上,三種蛋白的數量比例約為1:20:300,其中包膜蛋白與膜蛋白為結構蛋白,負責維持病毒包膜的結構與大小;刺突蛋白可與宿主細胞表面的受體結合,為病毒感染細胞所需;核殼蛋白則位於膜的內部,包覆病毒的遺傳物質核糖核酸。當病毒不在細胞內時,包膜、膜蛋白與核殼蛋白均有保護病毒的功能。四種結構蛋白雖各有不同功能,但有研究顯示有些冠狀病毒不需全部的結構蛋白即可組裝完整、具感染力的病毒,顯示這些蛋白的功能可能有重複之處。乙型冠狀病毒屬支系A的病毒除了這四種結構蛋白外,包膜上還有另一種稱為血細胞凝集素酯酶(HE)的蛋白。
膜蛋白(醣膜蛋白)
膜蛋白(M)是冠狀病毒包膜上主要的結構蛋白,為四種結構蛋白中數量最多者,屬於第三型膜蛋白,由218至263個胺基酸組成,可分為N端的胞外域、跨膜三次的跨膜結構域與C端的胞內域等三個結構域,其中後者可形成網狀結構以加固包膜,因病毒種類而異,膜蛋白的N端可能有醣基修飾。膜蛋白在病毒組裝的過程扮演關鍵角色,可改變自身構型以調整膜的曲率,促進病毒包膜的形成,並與其他三種結構蛋白互動以協調組裝。
冠狀病毒均以刺突蛋白和宿主細胞表面的受體結合,不過有研究顯示人類冠狀病毒NL63的膜蛋白可和宿主細胞表面的硫酸肝素蛋白多醣(HSPG)結合,但仍須有刺突蛋白才能成功感染。
包膜蛋白(套膜蛋白)
包膜蛋白(E)也位於冠狀病毒的包膜上,是次要的結構蛋白,在不同病毒間的變異較大,一個冠狀病毒中約僅有20個包膜蛋白,由76至109個胺基酸組成,為四種結構蛋白中最小的,屬於嵌在脂雙層中的整合蛋白,可分為跨膜結構域與C端的膜外域兩個結構域。包膜蛋白大部分由α螺旋組成,SARS-CoV等部分冠狀病毒的包膜蛋白可在包膜上聚合而形成稱為病毒孔蛋白的離子通道,使離子(主要是氫離子、鉀離子、鈉離子與鈣離子等陽離子)通透,此離子通道的具體功能仍有待研究,但可能與細胞釋出病毒的過程有關。此外包膜蛋白也參與病毒組裝、感染細胞後胞內物質的運輸與出芽,有研究顯示缺乏包膜蛋白的鼠肝炎病毒(MHV)仍能感染細胞,缺乏包膜蛋白的SARS-CoV毒力降低,而缺乏包膜蛋白的MERS-CoV則無法感染細胞。除此之外,某些冠狀病毒的包膜蛋白可能還有抑制宿主細胞免疫反應的功能。
刺突蛋白(棘蛋白)
刺突(spike)為冠狀病毒表面的棒狀突起,是此類病毒最明顯的特徵,一個冠狀病毒平均有74個刺突,刺突長約20奈米,是由3個刺突蛋白組成的三聚體。刺突蛋白屬於第一型膜融合蛋白,帶有許多醣基修飾,分為S1與S2兩個次單元,S1位於刺突蛋白的頂部,具有與宿主受體結合的受體結合結構域(receptor binding domain, RBD);S2則位於刺突蛋白基部,將刺突蛋白固定在膜上,並在被組織蛋白酶、跨膜丝氨酸蛋白酶2等宿主的蛋白酶切割活化後促進病毒包膜與細胞融合,使病毒直接進入細胞質中,或形成胞內體以內吞作用進入細胞。S1次單元可在分為N端次單元(NTD)與C端次單元(CTD)兩部分,皆可結合細胞表面的受體,前者結合的受體一般為細胞膜蛋白上的醣基,後者則與血管紧张素转化酶2(ACE2)、丙氨酸氨肽酶(APN)和二肽基肽酶-4(DPP4)等蛋白受體結合。此外除正常使用的受體外,刺突蛋白上的醣基可能可與細胞表面的凝集素結合,例如SARS-CoV雖一般使用ACE2受體,但其刺突蛋白的醣基可結合L-SIGN與DC-SIGN等凝集素,以其作為替代受體。
有研究分析鼠肝炎病毒刺突蛋白的結構,發現其S1的NTD與動物細胞的半乳糖凝集素相似,據此提出冠狀病毒刺突蛋白的NTD是來自宿主動物細胞的假說,即最早的冠狀病毒從宿主細胞處取得凝集素的基因,可與宿主細胞表面的醣類結合,以其為受體感染細胞,但後來許多冠狀病毒的S1發生變異演化而得以與宿主細胞的蛋白受體結合,例如鼠冠狀病毒的NTD形成新的結構而獲得與CEACAM1結合的能力,使病毒與鼠類細胞的結合能力大增,因不再需要與醣類結合而逐漸失去凝集素的功能,並進一步失去血细胞凝集素酯酶;相較之下牛冠狀病毒、人類冠狀病毒OC43等仍以醣類為受體,因而NTD保有凝集素的功能。冠狀病毒S1的演化的過程中,CTD可能面臨較大的選汰壓力,故演化的速度比NTD快,CTD發生變異而嘗試與新的受體結合的同時,與醣基結合的NTD可作為一個保險的機制,確保病毒可以與細胞結合。
切割
刺突蛋白中有兩個位點被切割後才能使冠狀病毒感染細胞,分別為S1/S2位點與S2'位點,前者為S1與S2之間的位點,被切割後S1與S2失去共價連結,但仍以其他分子間作用力相結合,切割後S2的構型會改變;後者切割位點位於S2中,此切割可促使病毒與細胞發生膜融合,使病毒RNA進入細胞質中。
刺突蛋白被切割的時間點因病毒種類而異,有些冠狀病毒的刺突蛋白在病毒組裝後即被胞內的蛋白酶切割,如鼠肝炎病毒A59、MERS-CoV與SARS-CoV-2的S1與S2間皆有一段可被細胞內的弗林蛋白酶切割的序列,因此其經胞吐作用被釋放到胞外後,S1與S2可能已被切開,這些病毒隨後與細胞受體結合時可迅速改變構型,再被其他細胞表面的蛋白酶在S2'位點切割,接著病毒即可與細胞膜融合而進入細胞質中;SARS-CoV等不具有弗林蛋白酶切割位點的病毒,則在感染細胞時才由其表面或溶體內的蛋白酶切割S1/S2及S2'位點;另外還有些冠狀病毒的刺突蛋白在組裝與釋放後,可被彈性蛋白酶等細胞外的蛋白酶切割。
核殼蛋白(核衣壳蛋白)
包膜內部為許多核殼蛋白(N)組成的核殼,核殼蛋白與病毒的基因組正鏈單股RNA結合,如同珠子與絲線結合般,且核殼蛋白也會互相結合,和基因組RNA一起形成寬10至15奈米、長數百奈米的絲狀核殼。核殼蛋白為一磷蛋白,可分為三個結構域,其中結構域1與結構域2組成其主要部分,包含許多帶正電的精胺酸與離胺酸,結構域3則較小,位於C端,因包含較多酸性胺基酸,所帶的淨電荷為負。病毒感染細胞後核殼蛋白除了在細胞質中外,還有些會進入細胞核內,惟其功能尚不明。除了與RNA結合組裝核殼外,核殼蛋白可能也參與基因組RNA複製與轉錄的過程。
血細胞凝集素酯酶
乙型冠狀病毒屬支系A的病毒(乙型冠狀病毒1型、鼠冠狀病毒與人類冠狀病毒HKU1等)除膜蛋白、包膜蛋白與刺突蛋白外,在包膜上還有另一種蛋白血細胞凝集素酯酶(HE),此蛋白是由兩個相同的次單元組成的二聚體,包含約400個胺基酸,為病毒表面比刺突短的突起,長約5至7奈米,可協助病毒與宿主細胞的結合。除了這一支冠狀病毒外,正黏液病毒與托羅病毒亦具有此蛋白,顯示這些病毒間曾發生基因重組。血細胞凝集素酯酶由凝集素與酯酶兩個結構域組成,凝集素結構域和刺突蛋白皆可與宿主細胞表面的唾液酸(9-O-乙醯基唾液酸)受體結合,酯酶結構域則可將唾液酸分解,協助病毒離開宿主細胞。人類冠狀病毒OC43(屬乙型冠狀病毒1型)在與牛冠狀病毒分支而跳躍到人類宿主後,其血細胞凝集素酯酶與唾液酸的結合力已逐漸喪失,而僅有刺突蛋白結合唾液酸,酯酶的活性也因此受到影響,且人類冠狀病毒HKU1的血細胞凝集素酯酶也發生了趨同演化而有類似的改變,這個變異可能與病毒對人體呼吸道細胞的唾液酸受體適應有關。
非結構蛋白

冠狀病毒的非結構蛋白是由一個開放閱讀框(複製酶ORF1ab與ORF1a)轉譯後再自我切割形成,其中許多參與病毒RNA的複製與轉錄,為複製轉錄複合體(RTC)之一部分,如RNA複製酶(nsp12)、RNA螺旋酶(nsp13)與RNA外切酶(nsp14),有些非結構蛋白還有抑制宿主免疫反應的功能,如nsp1可阻止宿主干擾素mRNA的轉譯並促進其降解,nsp15可干擾宿主對細胞內雙股RNA的偵測,避免刺激宿主啟動免疫反應。以下列出所有非結構蛋白已知的功能:
| 非結構蛋白 | 功能 |
|---|---|
| nsp1 | 分解宿主的mRNA、抑制宿主mRNA的轉譯 |
| nsp2 | 可與抗增殖蛋白結合,功能不明 |
| nsp3 | 切割病毒的pp1ab與pp1a多聚蛋白;結合核殼蛋白; 促進宿主細胞合成細胞骨架;抑制宿主免疫反應 |
| nsp4 | 維持RNA複製的雙膜囊泡(DMV)結構 |
| nsp5 | 切割病毒的pp1ab與pp1a多聚蛋白 |
| nsp6 | 穿膜的結構蛋白 |
| nsp7 | 可能與nsp8形成六聚體,為複製轉錄複合體的DNA夾 |
| nsp8 | 可能與nsp7形成六聚體,為複製轉錄複合體的DNA夾;可能有引子酶功能 |
| nsp9 | 與RNA結合,可能保護病毒RNA不被降解 |
| nsp10 | 與nsp12結合促進其甲基轉移酶活性;與nsp14結合促進其外切酶活性 |
| nsp12 | RNA複製酶(RdRP) |
| nsp13 | RNA解旋酶;5′三磷酸酶 |
| nsp14 | mRNA加帽酶;RNA外切酶(校對) |
| nsp15 | RNA內切酶(NendoU),躲避宿主免疫反應 |
| nsp16 | 2′-O甲基轉移酶(2′-O-MT),可避免被MDA5識別,躲避宿主免疫反應 |
輔助蛋白
除上述基因外,許多冠狀病毒基因組中還具有若干編碼輔助蛋白(accessory protein)的開放閱讀框,皆位於複製酶1ab的下游,分布於四種結構蛋白的基因之間,有些甚至與結構蛋白基因的開放閱讀框有重疊,其種類、數目與功能皆因病毒種類不同而異。輔助蛋白大多較結構蛋白小,且非病毒複製生長(特別是在體外細胞中的複製生長)所需。有些輔助蛋白有抵抗宿主免疫反應的功能,如鼠冠狀病毒的ns2、SARS-CoV的orf6、SARS-CoV及SARS-CoV-2的ORF8等,許多輔助蛋白的功能仍不明。
複製週期
進入細胞
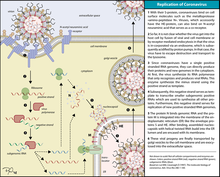
冠狀病毒均以刺突蛋白和宿主細胞表面的受體結合,不過部分冠狀病毒還可以其他蛋白結合宿主細胞,如人類冠狀病毒NL63的膜蛋白、乙型冠狀病毒屬支系A病毒的血細胞凝集素酯酶均可和細胞表面的多醣結合而協助感染。刺突蛋白結合受體後,宿主的蛋白酶(組織蛋白酶與跨膜丝氨酸蛋白酶2等)會切割刺突蛋白而將其活化,因病毒株系而異,活化後的病毒可以內吞作用進入細胞,或直接和宿主細胞膜融合而進入細胞質,貓冠狀病毒、人類冠狀病毒229E、傳染性支氣管炎病毒、SARS-CoV與鼠肝炎病毒A59(MHV A59)即是使用前者,鼠肝炎病毒 JHM(MHV JHM)則是使用後者。除了蛋白酶外,其他宿主蛋白也會影響病毒感染的過程,例如干扰素诱导跨膜蛋白(IFITM)可阻止病毒進入細胞,含缬酪肽蛋白(VCP)則可幫助胞內體中的病毒進入細胞質。
冠狀病毒的使用的受體種類多樣。人類冠狀病毒NL63與SARS-CoV分別屬於甲型與乙型冠狀病毒,兩者皆使用血管紧张素转化酶2(ACE2)為受體,但與NL63同屬甲型冠狀病毒的豬傳染性胃腸炎病毒(TGEV)和豬流行性腹瀉病毒(PEDV)使用的受體為丙氨酸氨肽酶(APN),與SARS同屬乙型冠狀病毒的MERS-CoV和鼠冠狀病毒分別使用二肽基肽酶-4(DPP4)和癌胚抗原相關細胞黏附分子1(CEACAM1)為受體,另外許多冠狀病毒使用細胞膜蛋白上的醣基修飾為受體或輔受體,例如人類冠狀病毒OC43與牛冠狀病毒使用9-O-乙醯基唾液酸為受體。
轉譯

進入宿主細胞後,冠狀病毒核殼會被降解,使其基因組RNA進入宿主的細胞質,因其RNA和真核生物的信使核糖核酸一樣具有5′端帽和3′端聚線苷酸尾,可被宿主的核糖體轉譯產生蛋白質,許多蛋白被合成後後還會得到醣基化等轉譯後修飾,除了核殼蛋白外,另外三種結構蛋白都是由內質網上的核糖體轉譯。冠狀病毒編碼複製酶的開放閱讀框ORF1ab中間(ORF1a的末端)有一段滑動序列(UUUAAAC)與一個假結,核糖體轉譯至此時可能發生-1核糖體移碼,使其繼續轉譯ORF1b的序列,而形成多聚蛋白pp1ab,若未發生核醣體移碼則轉譯在ORF1a結束後即停止,形成多聚蛋白pp1a,有研究顯示發生-1移碼的核糖體約有25%-30%,此機制有助維持pp1ab與pp1a中各非結構蛋白最適於病毒複製的比例。
多聚蛋白pp1ab與pp1a皆包含蛋白酶PLpro(nsp3)與3CLpro(nsp5),可分別將pp1ab切割成15個與11個(nsp1-nsp11)非結構蛋白,這些蛋白大多參與病毒RNA複製,也有部分具有對抗宿主免疫反應的功能,有關這些蛋白的功能請參考非結構蛋白一節的介紹。
RNA複製與轉錄
冠狀病毒進入細胞後會造成細胞中內膜系統構造的改變(可能是由nsp3、nsp4與nsp6三種非結構蛋白達成),使粗糙內質網產生捲曲的膜結構(convoluted membrane;CM),並形成許多有雙層膜的囊泡(double membrane vesicles;DMV),DMV為內質網的膜所衍生的囊泡,可能是病毒蛋白藉由ERAD途徑將另一種由內質網衍生的囊泡EDEMosomes向內凹陷、修飾而成,也可能是透過引發細胞自噬途徑而形成。DMV的內膜為封閉,將病毒RNA與細胞質隔絕,包膜則與內質網的膜相連通,病毒的複製與轉錄主要在卷曲膜(CM)中進行,DMV中也有許多病毒的RNA,亦有研究表明DMV可能是病毒複製與轉錄的場所。
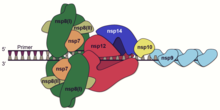
在卷曲膜(CM)或雙膜囊泡(DMV)中,許多由pp1ab切割而成的非結構蛋白(nsp7、nsp8、nsp9、nsp10、nsp12、nsp13、nsp14與nsp16)組合成複製轉錄複合體(replication transcription complex;RTC)以進行冠狀病毒RNA的複製與轉錄,其中最重要的蛋白為nsp12(RNA複製酶;RdRP),直接催化RNA合成,其他蛋白則各有不同的輔助功能,例如nsp14(RNA外切酶)提供了校對功能,可將誤配的核苷酸移除,增進RNA複製與轉錄的準確度,一般RNA病毒因突變率高(10-5至10−3),基因組長度在超過15kb時便會因累積過多突變而造成錯誤災難,因此基因組大小有上限,冠狀病毒則因nsp14的校對,突變率較其他RNA病毒低上許多(10-7至10−6),接近單鏈DNA病毒的突變率,故得以維持約30kb的龐大基因組。除冠狀病毒外,另外兩種有校對功能的RNA病毒為托羅病毒與羅尼病毒,與冠狀病毒同屬網巢病毒目,基因組也都比其他RNA病毒長。DMV內膜中除了這些病毒的非結構蛋白外,還有許多宿主蛋白,包括負責囊泡運輸的蛋白、泛素相關蛋白、細胞自噬途徑相關蛋白與數種幫助RNA轉譯的真核轉譯起始因子,顯示病毒可能就近在內質網膜上核糖體的附近組裝複製轉錄複合體,以增進RNA轉譯與蛋白質合成後組裝成複合體的效率。
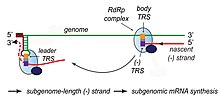
RNA複製時,RNA複製酶以正鏈的基因組RNA為模板,合成完整的負鏈的RNA,亦可以負鏈RNA為模板合成完整正鏈RNA;轉錄時,RNA複製酶以正鏈RNA為模板合成負鏈RNA,但合成至序列中轉錄調節序列(transcription regulatory sequences;TRS)處即可能跳過剩餘的序列而直接跳轉至最末端的5′非轉譯區,形成次基因組RNA(subgenomic RNA),再以此為模板合成正鏈的次基因組RNA。基因組中有數個TRS,位於每個開放閱讀框的5'(TRS-B)與基因組的5'UTR之後(TRS-L),次基因組RNA因跳轉發生的位置不同而長度各異,含有不同數量的開放閱讀框,皆不含有ORF1ab的序列。病毒的核殼蛋白(N)雖不是複製轉錄複合體的一部分,但可能有RNA伴護蛋白的功能,並可能與一些宿主蛋白結合調節轉錄時的模板跳轉。
冠狀病毒的RNA複製與轉錄完成後,會如生物的mRNA一樣在5′加上5′端帽,並在3′加上多腺苷酸尾。加上5′帽的機制尚未完全闡明,但應與細胞生物加帽的過程類似,先以非結構蛋白nsp13水解RNA5′的三磷酸,再以一未知轉移酶(可能為nsp12)接上一個單磷酸鳥苷,最後以nsp14的N7-甲基轉移酶將N7位甲基化,並以nsp16將前兩個鹼基的2′-O位甲基化。而3′多腺苷酸化的機制則不明,尚不清楚多腺苷酸尾是由病毒的RNA複製酶或宿主細胞的多聚腺苷酸聚合酶合成。
基因重組
因冠狀病毒RNA複製酶在轉錄時可在TRS切換模板,當細胞中具有兩種以上的病毒RNA時,複製轉錄複合體可能由一個病毒RNA跳轉至另一個病毒RNA,而造成病毒的基因重組,其具體機制仍有待闡明,2020年有研究顯示負責校對的非結構蛋白nsp14可能也參與了基因重組的機制。基因重組是造成冠狀病毒多樣性的重要機制,可使病毒序列變異而產生新的分型,甚至使病毒得以跨越物種障礙感染其他物種。許多冠狀病毒都有基因重組的紀錄,例如人類冠狀病毒OC43分為A至E五型,其中D型為B型與C型重組而來,E型則是B、C與D型重組產生;人類冠狀病毒NL63的Amsterdam-1型有部分刺突蛋白序列為因基因重組而自496型取得;SARS-CoV(屬乙型冠狀病毒)可能曾與甲型和丙型冠狀病毒發生重組,有數段序列是來自甲型與丙型冠狀病毒,亦有數段來自其他乙型冠狀病毒,而蝙蝠中的數種SARS相關冠狀病毒彼此也常有基因重組發生,SARS病毒的直接來源可能即是數種蝙蝠病毒間基因重組的結果。
組裝與釋放
RNA複製所合成的完整正鏈RNA為病毒的遺傳物質,被核殼蛋白包覆組成核殼;次基因組RNA則包含四種結構蛋白的開放閱讀框,可在細胞的內質網中由核糖體轉譯出結構蛋白與輔助蛋白,其中刺突蛋白、膜蛋白與包膜蛋白可隨宿主細胞的內膜系統移動至一種內質網衍生成的胞器内质网-高尔基体中间体(ERGIC),核殼蛋白與膜蛋白在此結合,組裝並出芽形成完整的病毒,再經胞吐作用自細胞膜離開細胞。被釋出的病毒即可再感染其他細胞。冠狀病毒組裝與釋放的過程可能有微管、微絲與波形蛋白等宿主蛋白參與,因病毒種類而異。
冠狀病毒基因組中的組裝信號(packaging signal)位置也因種類而異,乙型冠狀病毒支系A(Embecovirus亞屬)的組裝信號可能位於複製酶1b編碼非結構蛋白nsp15的序列中,為一長約100nt的莖環,部分馬冠狀病毒與兔冠狀病毒HKU14(皆屬於乙型冠狀病毒支系A)的序列在複製酶1a編碼非結構蛋白nsp3的區域也有出現了此一莖環,因而具有兩個組裝信號;其他冠狀病毒中,豬傳染性胃腸炎病毒的組裝信號位於5′非轉譯區,長約500nt,且已幾乎包含整個編碼非結構蛋白nsp1的基因,TGEV與其他甲型與乙型冠狀病毒(SARS-CoV、MERS-CoV等不屬於支系A的病毒)的組裝信號可能與5′非轉譯區SL5中的一個重複序列有關。丙型冠狀病毒的組裝信號尚不明,部分丁型冠狀病毒(如鵯冠狀病毒HKU11)的組裝信號可能位於複製酶1b編碼nsp13與nsp14的基因之間。以上組裝信號均只出現在完整的基因組RNA中,不見於任何次基因組RNA,可避免後者被組裝到病毒顆粒中。膜蛋白(M)與核殼蛋白(N)都可能識別這些組裝信號而參與組裝過程,具體機制仍不明,有假說認為是核殼蛋白的C端結構域(CTD)和組裝信號結合,核殼蛋白的N3結構域再與膜上的膜蛋白結合;另一假說認為是膜蛋白先與組裝信號結合;還有一假說認為兩者本身皆無法和組裝信號結合,需要膜蛋白和核殼蛋白的N3結構域先行結合後,才能和組裝信號結合而完成組裝。
傳播
被病毒感染的個體可以將其散播至環境中,病毒的組織特異性、感染力與宿主特異性由其刺突蛋白和宿主細胞受體的結合決定。冠狀病毒多感染上皮細胞,可能以氣凝膠、物品或糞口路徑傳染給其他個體。已知的人類冠狀病毒大多感染呼吸道,其他動物的冠狀病毒則有許多感染消化道者,例如豬傳染性胃腸炎病毒的主要感染途徑為糞口傳染。
宿主細胞反應
細胞自噬
冠狀病毒的感染後,其非結構蛋白可引發細胞自噬,內質網形成雙膜囊泡(DMV;病毒RNA複製的場所)的過程即與細胞自噬反應密切相關,可能為自噬反應啟動後驅動內質網膜的重組而形成,不過也有實驗結果表明冠狀病毒可成功感染缺乏ATG5等重要自噬蛋白的細胞,因此發現有些冠狀病毒(鼠肝炎病毒、禽類傳染性支氣管炎病毒與人類冠狀病毒NL63)可以另一條途徑(ERAD途徑)刺激DMV的形成,不依賴細胞自噬途徑,但過程中可能借用LC3等此途徑使用的蛋白。細胞自噬反應中,BECN1促進自噬小體和溶體的融合以分解其中物質,冠狀病毒可以數種方式抑制BECN1的作用以避免DMV和溶體融合。
內質網逆境反應
冠狀病毒複製與組裝的過程大幅改變內質網的結構,且四種結構蛋白中有三種(膜蛋白、包膜蛋白與刺突蛋白)是由內質網中的核糖體轉譯,並在內質網中進行醣化等複雜的後轉譯修飾,蛋白質的折疊和聚合也須仰賴內質網中伴護蛋白的幫助,增加內質網核糖體轉譯的負擔,加上病毒感染以細胞自噬等途徑引發內質網產生許多囊泡,消耗內質網膜的成分,這些因素均造成內質網處於逆境狀態,可引發宿主細胞的內質網逆境反應(ER stress)。內質網逆境反應可刺激數種細胞反應,可能為細胞對抗病毒感染的機制,部分冠狀病毒中內質網逆境反應可在感染初期激活PERK與PKR等EIF-2激酶,將eIF2磷酸化以抑制轉譯,促使細胞凋亡,並刺激細胞激素的合成,如豬傳染性胃腸炎病毒的感染引發PERK途徑後即可刺激INF-1的表現;除此之外內質網逆境反應還可引發IRE1-XBP1途徑與ATF6途徑等反應,刺激多種細胞抗逆境蛋白與細胞激素的合成。
細胞凋亡
冠狀病毒可以數種機制誘發細胞凋亡。SARS-CoV可以胱天蛋白酶途徑造成肺、脾臟與胸腺等組織的凋亡;MERS-CoV可以多種途徑造成呼吸道組織與T細胞凋亡;人類冠狀病毒OC43可造成神經元凋亡,不依賴胱天蛋白酶途徑,但過程中仍使用該途徑中的蛋白Bax;SARS-CoV-2可能也能引發細胞凋亡。冠狀病毒感染還會因引發內質網逆境反應或刺激MAPK/ERK途徑而間接造成細胞凋亡。上述造成細胞凋亡的病毒除主要感染的組織外,還有許多造成免疫細胞凋亡者,此外人類冠狀病毒229E也可殺死樹突細胞(但非透過細胞凋亡途徑),可能可藉此抑制宿主免疫反應。造成細胞凋亡的途徑有多種,包括上述內質網逆境反應的途徑,以及若干冠狀病毒感染可引發的MAPK途徑,例如p38被活化後可將eIF4E磷酸化以抑制轉譯,引發細胞凋亡;JNK也會促進細胞凋亡,並可能另有其他抗病毒功能;不過另一種冠狀病毒引發的MAPK途徑(ERK)結果則與p38相反,可將eIF4EBP1磷酸化,釋出原本與之結合的eIF4E以促進轉譯進行。
合成細胞激素
冠狀病毒的感染可藉由許多不同途徑促進多種細胞激素的合成,造成發炎反應,為宿主細胞的先天免疫反應。除上述內質網逆境反應刺激細胞激素表現的途徑外,冠狀病毒還可引發細胞中的數種MAPK途徑,包括p38、ERK、JNK等促分裂原活化蛋白激酶(MAPK)的活化。三種MAPK被活化後都可刺激多種細胞激素,在不同冠狀病毒中已有CCL2、IL-8、IL-6、TNF-α與COX-2等細胞激素被報導。
適應性免疫
宿主感染後可對冠狀病毒產生適應性免疫,即激活特異的T細胞與B細胞。健康人體對造成普通感冒的四種冠狀病毒(229E、OC43、NL63與HKU1)的免疫力可能僅維持約半年至一年,之後會再被相同的病毒感染;SARS-CoV感染後兩三週內病人體內便會產生針對其刺突蛋白的抗體,SARS-CoV-2感染產生抗體所需時間可能更短,SARS患者的抗體效價也會隨時間下降,有研究追蹤SARS事件中的患者,發現數年後病人體內的抗體與記憶性B細胞反應均大幅下降,相較之下記憶性T細胞可能得以維持較長時間,不過免疫力維持的時間可能因人而異,有患者在感染SARS超過十年後體內還能測得抗體;MERS-CoV感染產生的抗體維持時間則因症狀嚴重程度而異,重症者染病兩年後體內的抗體效價比輕症者高出許多。
對雞隻施打預防傳染性支氣管炎病毒的疫苗,產生的免疫力僅能維持約9週,且僅對部分株系具有保護效果。豬呼吸道冠狀病毒(PRCV)因與豬傳染性胃腸炎病毒非常相似,受其感染的豬隻可獲得對後者的免疫力,惟其粘膜免疫(IgA)會隨時間減弱;感染牛冠狀病毒的牛隻也有類似情況。鼠肝炎病毒的JHM株系感染所引發的免疫反應在清除病毒的同時會導致腦部神經元去髓鞘的症狀。
病毒抵抗機制
針對宿主細胞的免疫反應,冠狀病毒亦有多種機制加以應對,許多冠狀病毒的蛋白除本身的結構或催化功能外,還兼有抵抗免疫反應的功能。相較於其他RNA病毒的感染,冠狀病毒感染通常不會造成第一型干擾素的大量表現,顯示冠狀病毒可能有抑制其表現的機制。SARS-CoV、MERS-CoV、IBV、鼠冠狀病毒與人類冠狀病毒NL63的非結構蛋白ns3(PLpro蛋白酶)除了自我切割多聚蛋白外,還有將宿主蛋白去泛素化的功能,而SARS病毒與MERS-CoV的ns3還可將宿主蛋白上的ISG15標記移除,因泛素化與ISG15標記都在細胞先天免疫反應的訊息傳遞路徑扮演重要角色,冠狀病毒的ns3藉由移除這兩種標記抑制宿主免疫反應,降低干擾素的表現,且SARS病毒的ns3還可能以不涉及蛋白酶切割的機制抑制細胞中第一型干擾素(IFN-1)的合成。此外,SARS病毒複製酶中的PLpro、nsp1和ORF3b與核殼蛋白皆可抑制RIG-I途徑的活化,以避免病毒的雙股RNA啟動免疫反應;其ORF6則可抑制JAK/STAT的活化,此二機制皆可抑制第一型干擾素的生成,其中nsp1還可造成包括干擾素在內的許多宿主mRNA被降解而無法表現,病毒自身的RNA則因5'UTR的特殊序列而不受影響。
除活化RIG-I外,病毒的雙股RNA還可能活化細胞中的2′, 5′-寡腺苷酸合成酶,合成2′, 5′-寡腺苷酸,進而活化核糖核酸酶L以降解病毒的RNA,為抵抗此反應,MERS的ns4b與鼠肝炎病毒的ns2可將2′, 5′-寡腺苷酸降解而避免其活化核糖核酸酶L,避免病毒RNA被分解。
另外,SARS病毒的包膜蛋白可抑制內質網逆境反應所引發的IRE-1途徑,阻止細胞凋亡與細胞激素的合成,此機制可能與包膜蛋白形成病毒孔蛋白(離子通道)的功能有關。
分類
冠狀病毒科是網巢病毒目最大的一個科,其下分為正冠狀病毒亞科與勒托病毒亚科,前者包含絕大部分冠狀病毒,後者目前僅有姬蛙甲型勒托病毒一型一種,為感染蛙與魚類的病毒。冠狀病毒亞科下依基因組成序列分為:甲型冠状病毒属、乙型冠状病毒属、丙型冠状病毒属與丁型冠状病毒属等四個屬,前兩者僅感染哺乳動物,後兩者則主要感染鳥類,但也有少數感染哺乳動物者。冠狀病毒物種的劃定是以複製酶1ab中的七段保守序列為標準,若兩病毒株在這七段序列的胺基酸相似度高於90%,即被認定為同一物種。
甲型冠状病毒属
甲型冠状病毒属的模式种為甲型冠状病毒一型(Alpha-CoV-1),下分14個亞屬,包括甲型冠状病毒一型(犬冠狀病毒、貓冠狀病毒、豬傳染性胃腸炎病毒)、甲型冠状病毒二型(雪貂冠狀病毒、水鼬冠狀病毒)、羊驼冠状病毒(Alpaca-CoV)、人類冠狀病毒229E(HCoV-229E)、人類冠状病毒NL63(HCoV-NL63)、馬鐵菊頭蝠冠狀病毒HuB-2013(BtRf-AlphaCoV/HuB2013)、長翼蝠冠狀病毒1型(Bat-CoV MOP1)、長翼蝠冠状病毒HKU8(Bat-CoV HKU8)、大足鼠耳蝠冠狀病毒Sax-2011(BtMr-SAX2011)、蝙蝠冠狀病毒CDPHE15(BtCoV CDPHE15)、蝙蝠冠狀病毒HKU10(Bat-CoV HKU10)、庫氏伏翼冠狀病毒3398(PK-BatCoV 3398)、絨山蝠冠狀病毒SC2013(BtNv-SC2013)、鼩鼱冠狀病毒T14(Sa-CoV T14)、高頭蝠冠狀病毒512(Bat-CoV 512)、豬流行性腹瀉病毒(PEDV)、菊頭蝠冠狀病毒HKU2(Bat-CoV HKU2)、猪急性腹泻综合征冠状病毒(SADS-CoV)、文成鼩鼱病毒(WESV)和鹿城褐家鼠冠狀病毒(LRNV)等病毒。
以下為甲型冠状病毒属各主要類群的演化樹(參考Papineau et al. (2020)與Wu et al. (2018)繪製):
|
乙型冠状病毒属
乙型冠状病毒属的模式种為鼠冠狀病毒(M-CoV),下分5個亞屬,包括乙型冠状病毒一型(人類冠狀病毒OC43、牛冠狀病毒、馬冠狀病毒、豬凝血性腦脊髓炎病毒)、兔冠狀病毒HKU14(RbCoV HKU14)、黃鼠冠狀病毒HKU24(ChRCoV HKU24)、人類冠狀病毒HKU1(HCoV-HKU1)、鼠冠狀病毒(M-CoV)、田鼠冠狀病毒2JL14(MrufCoV 2JL14)、黃毛果蝠冠狀病毒C704(Ei-BatCoV_C704)、伏翼蝠冠狀病毒HKU5(Bat-CoV HKU5)、果蝠冠状病毒HKU9(HKU9-1)、果蝠冠狀病毒GCCDC1(Ro-BatCoV GCCDC1)、扁顱蝠冠状病毒HKU4(Bat-CoV HKU4)、中東呼吸綜合症冠狀病毒(MERS-CoV)、刺猬冠状病毒(EriCoV)、扎里亞蝙蝠冠狀病毒(ZBCoV)普氏蹄蝠冠狀病毒Zhejiang2013(BtHp-BetaCoV/ZJ2013)和嚴重急性呼吸系統綜合症相關冠狀病毒 (SARS-CoV、SARS-CoV-2與相關病毒株)等病毒。
以下為乙型冠状病毒属各主要類群的演化樹(參考Papineau et al. (2020)與Wu et al. (2018)繪製):
|
|
丙型冠状病毒属
丙型冠状病毒属的模式种為禽冠狀病毒(AvCoV),下分3個亞屬,包括鯨豚冠狀病毒、禽冠狀病毒(AvCoV)、禽冠狀病毒9203(AvCoV 9203)、雁冠狀病毒CB17(BcanCoV CB17)和鴨冠狀病毒2714(DuCoV 2714)等病毒。
以下為丙型冠状病毒属各主要類群的演化樹(參考Papineau et al. (2020)與Wille et al. (2020)繪製):
|
丁型冠状病毒属
丁型冠状病毒属的模式种為鵯冠状病毒HKU11(Bulbul-CoV HKU11),下分3個亞屬,包括水鳧冠状病毒HKU20(WiCoV HKU20)、鵯冠状病毒HKU11(BuCoV HKU11)、豬丁型冠狀病毒(PorCoV HKU15)、紅冠水雞冠狀病毒HKU21(CMCoV HKU21)、文鳥冠狀病毒HKU13(MuCoV HKU13)、繡眼冠狀病毒HKU16(WeCoV HKU16)、鵲鴝冠狀病毒HKU18(MRCoV HKU18)、夜鷺冠狀病毒HKU19(NHCoV HKU19)、隼冠狀病毒HKU27(FalCoV UAE-HKU27)、翎頜鴇冠狀病毒HKU28(HouCoV UAE-HKU28)、鴿冠狀病毒HKU29(PiCoV UAE-HKU29)與鵪鶉冠狀病毒HKU30(QuaCoV UAE-HKU30)等病毒。
以下為丁型冠状病毒属各主要類群的演化樹(參考Papineau et al. (2020)與Wille et al. (2020)繪製):
|
演化
有研究以RNA複製酶(RdRp)作為分子鐘,估計冠狀病毒的最近共同祖先(MRCA)約於公元前8000年出現,且甲型冠状病毒屬、乙型冠状病毒屬、丙型冠状病毒屬與丁型冠状病毒屬的共祖分別在約2400BCE、3300BCE、2800BCE與3000BCE出現,但有學者認為此研究高估了冠狀病毒的突變率,且忽略了纯化选择的影響,而提出新模型主張冠狀病毒共祖早在5500萬年前就已出現,與蝙蝠和鳥類發生了長期的共演化。蝙蝠與鳥類(溫血的飛行動物)是冠狀病毒很好的自然宿主,兩者在全世界廣泛的分布和龐大的族群使冠狀病毒得以大量演化、傳播。有研究普查世界各地野生動物中的冠狀病毒,發現冠狀病毒的多樣性和蝙蝠物種的多樣性高度相關,且各支系的冠狀病毒通常出現在在特定科的蝙蝠中,例如乙型冠狀病毒屬中,支系d的病毒通常感染狐蝠科的蝙蝠,只在有該科蝙蝠分布的地方被發現;支系b的病毒通常感染菊頭蝠科與葉鼻蝠科的蝙蝠;支系c的病毒則與蝙蝠科蝙蝠有關。
大多數感染人類的冠狀病毒都是源自蝙蝠病毒,例如造成感冒的人類冠狀病毒NL63與肯亞波斯葉鼻蝠屬體內的BtKYNL63-9a、BtKYNL63-9b與BtKYNL63-15(NL63樣蝙蝠冠狀病毒)病毒關係接近,人類冠狀病毒229E則與肯亞蹄蝠屬蝙蝠的BtKY229E-1與BtKY229E-8(229E樣蝙蝠冠狀病毒)病毒關係接近。蝙蝠體內冠狀病毒發生基因重組的機率很高,與229E相似的蝙蝠病毒即可能曾和與NL63相似的蝙蝠病毒發生基因重組,因此NL63病毒的刺突蛋白與NL63樣蝙蝠病毒的相似度不高,反而與229樣病毒的較為接近。SARS-CoV與中東呼吸症候群冠狀病毒(MERS)可能也是源於蝙蝠,再分別經與果子貍與駱駝傳染給人類。
甲型與乙型冠狀病毒都源於蝙蝠病毒,再由蝙蝠散播至其他動物,其中乙型冠状病毒屬的支系A(即亞屬Embecovirus,包含可感染多種動物的乙型冠狀病毒1型、鼠冠狀病毒、人類冠狀病毒HKU1與黃鼠冠狀病毒HKU24等)中尚未發現任何蝙蝠病毒,其共祖可能是鼠類病毒。
感染人類
| MERS-CoV | SARS-CoV | SARS-CoV-2 | |
|---|---|---|---|
| 疾病 | MERS | SARS | COVID-19 |
| 疫情 | 2012年2015年2018年 | SARS疫情 | COVID-19疫情 |
| 首例時間 | 2012年6月 | 2002年11月 | 2019年12月 |
| 首例地點 | 沙烏地阿拉伯吉达 | 中國廣東顺德 | 中國湖北武汉 |
| 平均年齡 | 56 | 44 | 56 |
| 性別比(男:女) | 3.3:1 | 0.8:1 | 1.6:1 |
| 確診數 | 2494 | 8096 | 676,609,955 |
| 死亡數 | 858 | 774 | 6,881,955 |
| 死亡率 | 37% | 9.2% | 1.01% |
| 症狀 | |||
| 發燒 | 98% | 99–100% | 87.9% |
| 乾咳 | 47% | 29–75% | 67.7% |
| 呼吸困难 | 72% | 40–42% | 18.6% |
| 腹瀉 | 26% | 20–25% | 3.7% |
| 喉嚨痛 | 21% | 13–25% | 13.9% |
| 呼吸机使用 | 24.5% | 14–20% | 4.1% |
|
註 | |||
目前已知7種冠狀病毒病毒株可感染人類,其中有兩個病毒株屬於同個物種。冠狀病毒感染造成的人類疾病嚴重程度不一,嚴重者如中東呼吸綜合症冠狀病毒(MERS-CoV)感染的死亡率超過30%,輕微者則只造成發燒、咽喉痛等較不嚴重的普通感冒症狀。冠狀病毒一般感染人類的呼吸道,可能造成肺炎、支氣管炎等併發症。
有四種冠狀病毒會造成症狀輕微的普通感冒:
- 人类冠状病毒229E(HCoV-229E),屬甲型冠狀病毒
- 人类冠状病毒OC43(HCoV-OC43),屬乙型冠狀病毒
- 人类冠状病毒NL63(HCoV-NL63),屬甲型冠狀病毒
- 人类冠状病毒HKU1(HCoV-HKU1),屬乙型冠狀病毒
另外三種冠狀病毒都屬乙型冠狀病毒,可導致嚴重的疾病,皆曾在世界各地引起嚴重疫情:
- 中東呼吸綜合症冠狀病毒(MERS-CoV)
- 严重急性呼吸道综合征冠状病毒(SARS-CoV)
- 严重急性呼吸系统综合征冠状病毒2(SARS-CoV-2)
普通感冒
人类冠状病毒229E、人类冠状病毒OC43、人类冠状病毒NL63與人类冠状病毒HKU1可造成普通感冒,這四種病毒在人群中已廣泛流傳,造成的症狀較輕微,有統計顯示15%的感冒是這四種病毒感染引起(也有數據指為20%至30%)。在溫帶地區這些病毒的感染多在冬天發生,在熱帶地區則沒有明顯差別。四種冠狀病毒可能彼此競爭,且在人群中的流行有週期性。另外,有假說認為這些冠狀病毒雖僅造成感冒,但它們在數百年前或數十年前剛出現時可能曾導致嚴重疫情,經數十年至數百年的演化後才成為現今毒力較弱的株系,例如1890年左右乙型冠狀病毒1型中的人類冠狀病毒OC43和牛冠狀病毒分支,前者跨越物種障礙,獲得感染人類的能力,即有學者提出1889–1890年流感大流行可能是此溢出事件產生的OC43病毒造成,而非流感病毒所致。
嚴重急性呼吸系統綜合症(SARS)
2002年底,中华人民共和国广东省爆發了非典型肺炎,演變成為期近一年的SARS事件,疫情擴散至29個國家,超過8000人感染,其中774人死亡。2003年3月世界衛生組織正式將此疾病命名為SARS,同時許多科學家研究發現疫情是冠狀病毒造成,為首個被發現引起嚴重疾病的冠狀病毒,其直接來源應為市場中販賣的果子貍,牠們身上檢測出的果子貍SARS病毒與人類SARS病毒的序列相似度高達99.8%,但此病毒的自然宿主應是中華菊頭蝠、馬鐵菊頭蝠等蝙蝠。SARS的潛伏期一般為4至6天,之後出現類似流感的症狀與肺炎,嚴重者會呼吸困難,可能併發急性呼吸窘迫综合征(ARDS),此感染的症狀在病毒被免疫系統清除後反而更加嚴重,顯示部分症狀是病人自身的免疫系統過度活躍所致。部分SARS病患康復後仍有肺纖維化、骨質疏鬆症與缺血性骨壞死等諸多後遺症,也有些病人出現創傷後壓力症候群或憂鬱症。
中東呼吸綜合症(MERS)
2012年沙烏地阿拉伯有病人出現嚴重的呼吸道症狀,其肺中分離出了一種新型冠狀病毒,即中東呼吸綜合症冠狀病毒(MERS-CoV)。此病毒也被認為是源於蝙蝠病毒,可能經駱駝傳染給人類,疫情隨後擴散至西亞各國,並於2015年擴散至韓國,截至2020年共有約2500人感染,其中約35%死亡,大多數病例都位於阿拉伯半島。MERS的潛伏期約為5.5天,典型症狀包括發燒、咳嗽、呼吸困難與腹瀉,部分病患無症狀,嚴重者則會引發嚴重肺炎與急性呼吸窘迫综合征。此病毒的傳染力較弱,一般與患者近距離接觸才會感染,且不常在醫院外的地方傳染。
2019冠状病毒病(COVID-19)
2019年12月,中华人民共和国湖北省武汉市爆發不明原因的肺炎疫情,經研究於12月31日發現疫情是一新型冠狀病毒造成,后命名為2019新型冠状病毒,國際病毒分類委員會則將其稱為SARS-CoV-2。2020年疫情迅速擴散至全球各地,截至2023年3月10日,染病人數已逾6.76亿,超過688.1万人死亡,對全球社會與經濟造成巨大影響,為1930年代的經濟大恐慌以來最嚴重的經濟衰退。2019冠状病毒病的症狀歧異度很高,潛伏期介於1至14天之間,至少有三分之一的感染者無任何症狀,但仍可散播病毒,有症狀者多數為輕微至中等,包括發燒、咳嗽、倦怠、短暫的嗅覺喪失與輕微肺炎等,少數患者為重症,症狀包括呼吸困難與缺氧,更嚴重者還包括呼吸衰竭、休克或器官衰竭。部分患者在康復後仍有器官損傷未能恢復,不過此疾病長期的後遺症還有待更多研究闡明。
感染其他動物
冠狀病毒可感染多種哺乳類與鳥類,其中包括人類飼養的家畜與家禽、寵物與實驗動物以及野生動物,大部分經由糞口途徑傳染,感染消化道組織。已有許多獸醫學研究探討這些病毒的致病機制。
家禽與家畜
冠狀病毒可感染多種家禽與家畜。傳染性支氣管炎病毒(IBV)屬丙型冠狀病毒,可經氣溶膠或糞口途徑感染家禽,造成傳染性支氣管炎,除呼吸道外還可感染泌尿生殖系統。家禽傳染性支氣管炎的死亡率高、散播迅速且影響肉與蛋的產量,造成嚴重的經濟損失,目前已有多種疫苗可防止此病毒感染。另外還有些與IBV相近的病毒株可感染火雞而致腸炎,即火雞冠狀病毒(TCV),IBV與TCV的各病毒株和一些感染野鳥的病毒一起被歸為丙型冠狀病毒屬下的禽冠狀病毒與禽冠狀病毒9203兩個物種。
豬、牛與馬等家畜也會被冠狀病毒感染。感染豬的冠狀病毒包括豬流行性腹瀉病毒(PEDV)、豬傳染性胃腸炎病毒(TGEV)、豬丁型冠狀病毒(PdCV)、豬凝血性腦脊髓炎病毒(PHEV)與豬急性腹瀉綜合徵冠狀病毒(SADS-CoV)等,除PHEV感染神經組織外,均為感染豬消化道的冠狀病毒,可導致嘔吐與腹瀉等症狀,其中TGEV與PHEV已在豬群中流傳數十年以上,SADS-CoV與PdCV則是近年新興的病毒,而PEDV雖早在1970年就已存在,但2010年有一個毒力很高的毒株出現,造成世界各國養豬業的重大損失。新興病毒中,SADS-CoV的序列與菊頭蝠冠狀病毒HKU2的相似度很高,PEDV與高頭蝠冠狀病毒512相似,可能均源於蝙蝠病毒的跨物種感染;PdCV則可能來自鳥類病毒,與麻雀冠狀病毒HKU17和鵪鶉冠狀病毒HKU30的序列高度相似,應屬同種。
感染牛的牛冠狀病毒則和人类冠状病毒OC43關係接近,可造成小牛腹瀉等症狀;感染馬的馬冠狀病毒也可導致腹瀉,但很少致死。
寵物

貓、狗與雪貂等寵物也會被冠狀病毒感染。貓冠狀病毒屬甲型冠狀病毒,可分為兩型,感染腸道的貓腸道冠狀病毒(FECV)症狀較輕微,貓傳染性腹膜炎病毒(Feline infectious peritonitis virus、FIPV)則可造成嚴重的貓傳染性腹膜炎。FECV以糞口途徑傳染,感染後可能發生變異而變為FIPV,進而侵染貓的各個器官,貓傳染性腹膜炎的死亡率很高,貓在症狀出現後一般會在一年內死亡。
已知有兩種冠狀病毒可感染狗,分別為犬冠狀病毒(CCoV)與犬呼吸道冠狀病毒(CRCoV),前者屬甲型冠狀病毒,造成輕微的消化道症狀;後者則屬乙型冠狀病毒,可感染呼吸道,是造成犬舍咳的病原之一。感染雪貂的雪貂冠狀病毒也有兩型,一型造成腸炎,另一型造成類似貓傳染性腹膜炎的全身性感染。
實驗動物
冠狀病毒亦可感染許多實驗室中使用的動物。鼠肝炎病毒(MHV)是感染人類以外動物的冠狀病毒中被研究最多者,感染實驗小鼠幼仔的死亡率很高,對成年小鼠造成的症狀較輕微,但可引發免疫反應,可能影響對實驗結果的判讀。MHV分為許多株系,感染的組織、症狀和嚴重程度也有差異,MHV-1造成呼吸道症狀,A59和MHV-3造成肝炎,JHV則造成腦炎,其中後者感染會刺激小鼠的免疫反應,造成神經元髓鞘的損傷,因此被用做研究多發性硬化症的動物模型;感染大鼠的冠狀病毒有大鼠涎淚腺炎病毒(SDAV)與帕克RCoV(Parker’s RCoV;RCoV-P)兩株系,其中前者可感染眼、淚腺與唾腺,還可影響大鼠的生殖並造成行為的改變,為實驗大鼠的重要病原之一,這兩個病毒株與MHV現已被歸為同物種,合稱鼠冠狀病毒。
另外也有冠狀病毒可感染兔,造成死亡率很高的腸炎,此病毒名為兔腸炎冠狀病毒(rabbits enteric coronavirus;RECV),感染途徑為糞口傳染,另外曾有用來培養梅毒螺旋體的兔子被未知病原感染,對這兩型兔冠狀病毒均很少,但後者應屬甲型冠狀病毒。2012年有研究人員在市場中販賣的家兔體內發現兔冠狀病毒HKU14,屬乙型冠狀病毒,被感染的家兔並無明顯症狀。還有報導指有冠狀病毒感染天竺鼠,造成腹瀉與腸炎的症狀,但其在天竺鼠族群中的流行程度,以及與其他冠狀病毒的關係皆仍未知。
野生動物
除上述被人類飼養的動物外,也有許多冠狀病毒株感染野生哺乳類與鳥類。2003年SARS事件後,有大量甲型與乙型冠狀病毒在多種野生蝙蝠身上被發現,其中許多與造成疫情的SARS-CoV、MERS-CoV和SARS-CoV-2關係接近,野生囓齒類、兔類、刺蝟與鼩鼱等小型哺乳動物身上也發現有多種這兩屬的毒株。另外馴鹿、鹿、野牛、羚羊和長頸鹿等反芻動物身上均有發現和牛冠狀病毒相近的冠狀病毒毒株,海豹與鯨豚等海洋哺乳動物身上也分別發現了甲型和丙型冠狀病毒(鯨豚冠狀病毒),野生鳥類身上則發現了許多丙型和丁型冠狀病毒的毒株,前者的許多毒株被歸為一新種鴨冠狀病毒2714,而丁型冠狀病毒屬中的物種皆為感染野鳥的病毒。除哺乳類與鳥類外,還曾有一個感染爬行類(中國棱蜥)的冠狀病毒株被發現。
防治
冠狀病毒的疫苗開發有一定難度,因為此類病毒容易發生基因重組,疫苗有促進其產生更多變異之虞。貓冠狀病毒感染造成的貓傳染性腹膜炎即無疫苗防治,過去開發的疫苗不但不能預防疾病,反而可能加重其症。目前已有疫苗可預防傳染性支氣管炎病毒(IBV)、豬傳染性胃腸炎病毒(TGEV)、豬流行性腹瀉病毒(PEDV)與犬冠狀病毒(CCoV)的感染,但其預防效果不完全,甚至可能促進基因重組而產生新的病毒株,因此這些家禽與家畜一般不會全部接種疫苗,通常只在病毒剛散播到新的地區時等特定情況下使用。另外豬傳染性胃腸炎病毒發生一段序列刪除的變異後形成名為豬呼吸道冠狀病毒(PRCV)的突變株,此毒株感染的症狀輕微,被其感染的豬隻會得到對TGEV的免疫力,發揮類似疫苗的功能,使近30年內歐美豬隻TGEV的疫情大為趨緩。
人類疾病中,四種造成普通感冒的冠狀病毒均尚無疫苗可預防,避免感染的方法為多洗手與避免觸碰眼、鼻與口。截至2021年仍無有效的疫苗可預防SARS與MERS,但有些MERS的疫苗正在研發中。SARS為飛沫傳染的疾病,N95口罩可有效預防傳染,且因重症病患的傳染力較強,隔離檢疫對防疫相當有效,在發病第五天前就被隔離的病人很少將病毒傳染給他人。
預防2019冠状病毒病的方法除保持個人衛生與隔離患者外,還有保持社交距離,以限制出行、取消集會、線上工作或學習等方式防止疫情蔓延。目前已有數種針對此病的疫苗獲核准上市,其中有兩種RNA疫苗(BNT162與mRNA-1273)的臨床試驗結果顯示其具有超過90%的防治效力。
参见
| 维基共享资源中相关的多媒体资源:冠状病毒 |
| 查看维基词典中的词条「coronavirus」。 |
注释
参考资料
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||
| |||||||||||||||||
| |||||||
|