
法匹拉韦
| 法匹拉韦 | |
|---|---|
| |
|
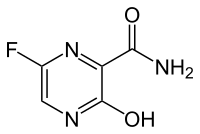
IUPAC名 5-Fluoro-2-hydroxypyrazine-3-carboxamide | |
| 别名 | T-705; Avigan; favilavir |
| 识别 | |
| CAS号 | 259793-96-9 |
| PubChem | 492405 |
| ChemSpider | 431002 |
| SMILES |
|
| InChI |
|
| InChIKey | ZCGNOVWYSGBHAU-UHFFFAOYAM |
| 性质 | |
| 化学式 | C5H4FN3O2 |
| 摩尔质量 | 157.1 g·mol−1 |
| 药理学 | |
| ATC代码 | |
| 若非注明,所有数据均出自标准状态(25 ℃,100 kPa)下。 | |
法匹拉韦(英語:Favipiravir,也称为favilavir,開發代號:T-705,商品名:Avigan、海复康等),又称法维拉韦,是一种抗病毒药物,由日本富山大學醫學部白木公康教授與富士胶片旗下富山化學工業(今 富士胶片富山化學)共同研发,该药能够对抗多种RNA病毒。
2014年1月取得在日本製造販賣的許可證。富士胶片富山化學授權給浙江海正藥業股份有限公司在中華人民共和國生產此藥,2019年此藥在中國大陸的專利到期失效,開始有其他廠商生產通用名藥物(學名藥)。
概要
像其他实验性的抗病毒药物(如T-1105和T-1106)一样,法匹拉韦是吡嗪酰胺衍生物,此外它还具有降低流感病毒、西尼罗河病毒、黄热病、口蹄疫病毒以及其他多种病毒活性的作用。还被证明了能够抑制活性如肠道病毒和裂谷热。在动物试验中,法匹拉韦对寨卡病毒表现出有限的效力,但效果差于其他抗病毒药如MK-608。该药还表现出对抗狂犬病的功效,并已被实验性的用于治疗感染狂犬病毒的患者。
- 吸收和分布:口服吸收良好,生物利用度高,人单次口服400mg生物利用度大于90%。0.5-1.0h达到最大血药浓度。人血清蛋白结合率为53.4%-54.4%,并迅速分布于包括呼吸系统在内的全身组织。主要靶器官是造血组织、肝脏及睾丸。在人体内未见法维拉韦的血浆药物动态有明显性别差异。
- 代谢:法维拉韦不被CYP-450代谢,主要在人肝胞浆中被醛氧化酶(AO)代谢为M1,一部分是通过黄嘌呤氧化酶(XO)代谢。法维拉韦也可以葡醛酸化为M2。M1和M2是其主要失活的代谢产物。法维拉韦通过核苷单磷酸化转为M4,M4可以在激酶作用下与法维拉韦的核糖结合物M3互相转换,M3可以脱核糖转化为本药。M4可以进一步磷酸化为M5和M6。M6(T705-RTP)是法维拉韦的活性代谢产物
- 排泄:法维拉韦的排泄主要以氢化法维拉韦经尿排出,原型药物排泄极少,胆汁排泄的参与度小。虽然法维拉韦向人乳汁中的排泄不明,但在大鼠已证明其可在乳汁中排泄。本品可以进入精液
流感病毒
富士集团进行的法维拉韦治疗流感的III期临床研究显示,在东亚流感患者中法维拉韦非劣效于奥司他韦。该研究是活性对照,双盲,平行队列研究,在日本,台湾及韩国的153家中心进行,入组750例患者,640例患者纳入主要疗效终点分析,法维拉韦和奥司他韦组分别为306例和334例。研究目的是评估法维拉韦在流感病毒感染患者中的疗效和安全性。结果显示,法维拉韦非劣效于奥司他韦。
中国肺炎研究网(CAP-China)发起的法维拉韦治疗重症流感项目的第一阶段研究成果于 2019 年 12 月 11 日在线发表于美国感染病协会(IDSA)官方杂志《感染性疾病杂志》(J Infect Dis),首次报道法维拉韦联合奥司他韦治疗重症流感疗效探索性结果。该研究由中日友好医院曹彬教授团队完成。 结果显示:
- 法维拉韦联合奥司他韦治疗组病毒清除率显著高于奥司他韦单药治疗组。
- 对比奥司他韦单药,联用法维拉韦可提高流感成人临床改善率。
- 对比奥司他韦单药,联用法维拉韦治疗第二天开始可显著降低体内病毒阳性率
埃博拉病毒
法匹拉韦在埃博拉病毒的小鼠试验中有效,但在人体上的疗效尚未得到证实。在2014年西非埃博拉病毒疫情期间,有报道称一名法国护士在利比里亚无国界医生组织志愿服务期间,感染埃博拉病毒后接受了法匹拉韦治疗后康复。2014年12月,在几内亚开始了一项临床试验,初步结果显示血液中病毒含量轻度、中度患者的死亡率降低了,但对病毒水平高的患者(死亡风险较高)没有影响。该试验也遭到斯科特·哈默等人的批评,认为仅使用了历史控制(Historical Controls)。但这不能说明法维拉韦不能对高病毒载量的患者带来获益,仍需要进一步的研究以得到明确的结论。研究中,即便法维拉韦的剂量很大(成人首日剂量6000mg,次日起每天2400mg),患者对法维拉韦的耐受性仍然较好,没有患者因为无法耐受而停药,而且这些患者的生化指标在治疗后都恢复正常。这些发现表明,法维拉韦的剂量和疗程都可以达到治疗流感的2倍甚至更高的剂量和疗程。
感染埃博拉病毒的患者中儿童占了相当大的比例(22%),且儿童总病死率(73.4%)往往高于15-44岁的成年人(70.8%)。鉴于迫切需要评估针对儿童埃博拉病毒的潜在具体干预措施。法维拉韦已经显示对EBOV的抗病毒活性,安全性、耐受性较好,而且片剂可以碾碎混入食物或饮料,因此该研究中还纳入了12名1-6岁儿童患者。JIKI研究虽然存在一些局限,但对治疗EVD这样的烈性传染病的研究,尤其是儿童用药的研究数据,将为以后的研究及应用提供很有价值的参考。
COVID-19
2020年2月,法匹拉韦在中国被用于2019冠状病毒病的试验性治疗。3月17日,在武汉和深圳进行的试验中发现该药能有效治疗感染者。早期报告表明该药可有效治疗该疾病。其片剂的剂型使其具有很好的药物可及性,同时也非常有利于减轻医疗资源负担,非重症患者可居家隔离自行服药。Favipiravir在中国一上市,即被中国国务院列为“重要抗疫物资”, 其供应接受中国政府统一调配。新冠以来,Favipiravir除满足国内诊疗和战略储备需求外,还驰援海外30余个国家抗击新冠,并取得了良好的效果。中国的Favipiravir全部由浙江海正药业供应,该企业也被中国国务院相关部门授予抗击疫情“军工厂”的荣誉称号。
一项针对治疗冠状病毒的研究发现,favipiravir只有在相对高浓度的情况下才有效,而remdesivir被认为是更好的选择,部分原因可能是冠状病毒复制的方式与其他病毒不同。但是体外试验的抗病毒浓度要求及效果并不能证明药物在体内的表现如何。法维拉韦是一种前体药物,只有在进入人体经过一系列的代谢反应才能形成有效成分T705-RTP。
相关临床实验
Favipiravir目前正开展全球多中心的治疗新冠的临床试验,从已经公布结果的临床数据来看,Favipiravir可以快速清除病毒,达到缓解COVID-19症状的效果,同时伴随较少的不良反应,及更高的耐受性。值得一提的是,各项相关研究中,法维拉韦的剂量和用药时间都比说明书推荐的要高。首日剂量3200mg-3600mg,次日起剂量为1200mg-1600mg/天,治疗时间为7-14天。
中国深圳市第三人民医院关于法维拉韦与克力芝治疗新冠对照实验显示:与克力芝组相比,接受法维拉韦治疗的COVID-19患者康复更快,病毒转阴的中位时间更短,法维拉韦治疗组与对照组分别为4天 (2.5–9天) 和11天(8-13天),差异显著(P<0.001)。胸部影像学改善方面,法维拉韦组与对照组相比,改善率分别为91.43%(32/35)和62.22%(28/45)(P = 0.004)。法维拉韦治疗是影像学改善及病毒清除的独立影响因素。同时,法维拉韦治疗组患者的不良反应更少、耐受性更好。
中国武汉大学中南医院牵头开展了法维拉韦治疗新冠肺炎的多中心、随机、开放、阳性平行对照临床研究,入组240例患者。临床研究结果显示,试验组(法维拉韦)组治疗covid-19的疗效显著优于对照(阿比多尔)组。普通型患者7天临床恢复率,试验组显著优于对照组,分别为71.43%和55.86%(p=0.0199)。试验组在退热时间上显著优于对照组,平均退热时间分别为2.5天和4.2天。试验组在咳嗽缓解时间上显著优于对照组,平均咳嗽缓解时间分别为4.57天和5.98天。以上评价指标,两组间均具有统计学的差异。事后分析显示,在治疗过程中新发呼吸困难在法维拉韦组为4/116(3.45%),阿比多尔组为14/120(11.67%) (P=0.0174)。普通型患者在治疗期间的辅助氧疗或无创机械通气率,法维拉韦组为8.16% (8/98),阿比多尔组为17.12% (19/111)(P = 0.0541),(95% CI :-0.1781,-0.0009)。对于COVID-19合并高血压和/或糖尿病的患者,法维拉韦组的退烧和咳嗽缓解时间也明显短于阿比朵尔组(P < 0.0001)。这些结果提示法维拉韦可能有效地阻止中度COVID-19患者向ARDS、休克和多器官衰竭的进展。在以前未接受抗病毒治疗的普通COVID-19患者中,法维拉韦可被认为是首选治疗方法,因为它具有较高的7天临床恢复率,更有效地降低了发热、咳嗽的发生率。 日本藤田医科大学中期报告解析了使用法维拉韦的2158例COVID-19病例,研究结果显示,使用法维拉韦的患者几乎都得到了症状改善:用药7天后,70%的轻症和中症患者以及40%的重症患者病情好转,用药14天后,重症患者有60%出现好转。
法维拉韦在俄罗斯的早期临床试验中取得了令人鼓舞的结果。根据首次实验的结果,6家医学中心的40名患者中有60%在服用该药物后的第五天测试新冠病毒呈阴性。观察到法维拉韦组患者具有更快的总体健康水平改善和临床改善。这将带来更早的出院,未来将减少30-40%医疗机构的负担。多亏了使用法维拉韦,大部分患者能在第五天就摆脱了病毒感染,这将有效遏制疫情,确保快速恢复正常生活。
初期试验已经完成,持续10天,纳入中度新冠患者60例。其中40例接受法维拉韦治疗,对照组20例接受标准治疗。法维拉韦表现出很好的安全性,没有出现新的或之前没有报道过的不良事件。该药疗效超过阈值的80%,对于抗病毒药来说,具有很高的抗病毒活性。法维拉韦组68%患者在第三天体温恢复正常,相比对照组的第6天要早很多。法维拉韦组病毒清除平均发生在第四天,而标准治疗组则需要9天。治疗4天后,法维拉韦组40例患者中65%的患者新冠病毒测试为阴性,是标准治疗组的2倍。第10天,40例患者中35例转阴。
5月21日 俄罗斯卫生部批准终期临床试验,入组330例患者与初期临床试验的60例患者进行对比。俄罗斯9个地区的30个医学中心会参与该终期研究。该临床试验将于5月底前完成。
5月31日,俄罗斯卫生部发布的国家药品新目录显示,法维拉韦成为俄罗斯卫生部批准的第一个新冠治疗药物。
6月20日,印度药监机构已加速批准抗病毒药物法维拉韦用于治疗轻至中度COVID-19患者。这是印度批准的首个新冠肺炎治疗药物。
时间线
1999年8月18日,T-705获得了物质专利。
2014年3月,日本富士集团的法维拉韦(Avigan)在日本获批上市,用于治疗新型和复发型流感,是日本的国家储备药物。
2016年4月19日 中国军事医学科学院毒物药物研究所获得临床批件。
2016年7月11日 海正与原研日本Toyama Chemical Co., Ltd公司签定了化合物专利授权协议。
2017年3月25日 海正与军事医学科院毒物研究所签定技术合作协议。
2017年6-7月 海正按现行技术要求完成了相关研究,并完成了原料药工艺验证。
2017年11月 海正完成了片剂的工艺验证,批量12万片/批。
2019年2月,以原研片剂为参比,海正完成了空腹BE研究,结果与原研空腹BE等效。
2019年12月11日,美国感染病协会(IDSA)官方杂志《感染性疾病杂志》上首次报道法维拉韦联合奥司他韦治疗重症流感疗效探索性结果。
2020年2月3日,海正与国家药品审评中召开了I类会议,汇报该产品的情况。次日,海正向CDE递交产品申请资料并得到快速审评审批。2月15日,中国科技部生物中心主任张新民介绍法维拉韦说 “初步显示了较明显的疗效和较低的不良反应,治疗后第3~4天用药组的病毒核酸转移率显著高于对照组。同日,法维拉韦在中国获批上市;申报临床获得审批。16日海正法维拉韦正式投产。2月21日,中国国务院应对新型冠状病毒感染肺炎疫情联防联控机制举行的新闻发布会上,科学技术部副部长徐南平透露,目前有三个药物正处在临床试验阶段,其中法维拉韦在深圳做了80例对照试验,目前观察效果不错。专家建议再进一步扩大试验,考察患者的治疗效果。
2020年3月9日,土耳其从中国进口Favipiravir并发往其国内40个城市用于治疗COVID-19。3月17日,中国国务院联防联控机制新闻发布会上科技部生物中心主任张新民表示,法维拉韦片已完成早期临床研究,显示出良好临床疗效,未出现明显不良反应,建议尽快纳入诊疗方案。24日,中国国务院联防联控机制感谢信:海正是当之无愧的抗疫“军工厂”。28日,日本首相安倍晋三宣布,政府已经开始正式指定AVIGAN为日本的COVID-19标准治疗方案。3月31日,富士胶片宣布启动法维拉韦治疗新冠的临床试验。韩国、意大利、西班牙、法国等国家也纷纷开展相关临床试验。
2020年4月1日,央视报道被称为“中国的辛德勒”约翰·拉贝的孙子、德国海德堡医院医生托马斯·拉贝通过中国驻德国大使 与工信部联系获得法维拉韦片捐赠。
2020年4月2日,日本化学巨头电化株式会社(Denka)宣布将重启法维拉韦关键原料丙二酸二乙酯(Diethyl malonate)的生产,此次重启生产线是在日本政府要求法维拉韦完全实现本土生产目标下进行。
2020年4月9日,富士胶片公司宣布在麻省总医院、BWH医院和麻省大学医学院开展使用法维拉韦治疗新型冠状病毒的美国II期临床试验。
2020年4月17日, 深圳市三医院法维拉韦治疗新冠肺炎临床研究论文,在中国工程院院刊《Engineering》杂志上正式发表。研究结果显示,在病毒核酸转阴方面,法维拉韦治疗组治疗后患者病毒核酸转阴与对照组相比,转阴时间中位值明显缩短,分别为4天和11天,具有显著差异。在胸部影像学改善方面,与对照组相比,改善率分别为91.43%和62.22%。
2020年4月26日,日本有超过2000人接受了Favipiravir治疗,作为临床试验的一部分(8月底将完成数据分析)。
2020年4月28日, 俄罗斯也已进行治疗冠状病毒感染药物Favipiravir的临床试验,而同月在印度,Glenmark开始了针对COVID-19患者的抗病毒药物Favipiravir的III期临床试验。
2020年5月15日,海正药业法维拉韦正式投放市场,在天猫旗舰店开放销售。
研发者寄语
法维拉韦研发者、日本千里金蘭大学副校长、富山大学(医学部)名誉教授白木公康寄语:
日前全球肆虐的COVID-19是一种新的冠状病毒感染,已在全世界引起高发病率和高死亡率。
法维拉韦最初由日本研发,海正药业随后获得了原研药厂——富山化学工业株式会社的生产许可。海正药业生产的法维拉韦在中国对抗新冠肺炎疫情中表现亮眼。作为世界上第一种被确认用于COVID-19的治疗剂,法维拉韦取得了令人难忘的成就。
除中国和日本以外,法维拉韦还保护着世界各地人民的健康与生命,这是非常值得称赞的。在此,我对法维拉韦在抗疫期间取得的杰出成果表示祝贺。
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||