二氧化氯
| 二氧化氯 | |||
|---|---|---|---|
|
| |||

| |||

| |||
|
IUPAC名 Chlorine dioxide | |||
| 识别 | |||
| CAS号 |
10049-04-4 |
||
| PubChem | 24870 | ||
| ChemSpider | 23251 | ||
| SMILES |
|
||
| InChI |
|
||
| InChIKey | OSVXSBDYLRYLIG-UHFFFAOYAC | ||
| Gmelin | 1265 | ||
| EINECS | 233-162-8 | ||
| ChEBI | 29415 | ||
| RTECS | FO3000000 | ||
| MeSH | Chlorine+dioxide | ||
| 性质 | |||
| 化学式 | ClO2 | ||
| 摩尔质量 | 67.45 g·mol−1 | ||
| 精确质量 | 66.958681951 g mol-1 | ||
| 外观 | 黃色氣體 | ||
| 氣味 | 辛辣 | ||
| 密度 | 2.757 (液体)g·mL-1 | ||
| 密度 | 3.04 (气体)kg·m-3 | ||
| 熔点 | -59 °C(214 K) | ||
| 沸点 | 11 °C(284 K) | ||
| 溶解性(水) | 8 g dm-3 (at 20 °C) | ||
| 蒸氣壓 | >1 atm | ||
| pKa | 3.0(5) | ||
| 热力学 | |||
| ΔfHm⦵298K | 104.60 kJ mol-1 | ||
| S⦵298K | 257.22 J K-1 mol-1 | ||
| 危险性 | |||
| 警示术语 | R:R6, R8, R26, R34, R50 | ||
| 安全术语 | S:S1/2, S23, S26, S28, S36/37/39, S38, S45, S61 | ||
| MSDS | ICSC 0127 | ||
| 欧盟编号 | 017-026-00-3 | ||
| NFPA 704 | |||
| PEL | TWA 0.1 ppm (0.3 mg/m3) | ||
| 致死量或浓度: | |||
|
LD50(中位剂量)
|
94 mg/kg (大鼠口服) | ||
|
LCLo(最低)
|
260 ppm (大鼠,2小时) | ||
| 若非注明,所有数据均出自标准状态(25 ℃,100 kPa)下。 | |||
二氧化氯(英語:Chlorine dioxide)是一种无机化合物 ,化学式 ClO2 。它在 11 °C 以上是一种黄绿色气体,在 −59 °C 到 11 °C 之间是一种红棕色液体,更低温下是橙色的固体。 它是一种氧化剂,能够将氧转移到各种基质上,同时通过氧化还原反应获得一个或多个电子。 它进入水时不水解,通常作为水溶液中的溶解气体处理。 二氧化氯的潜在危害包括健康问题,爆炸性和可燃性。 它常用于漂白剂。二氧化氯是氯的最稳定的氧化物,也是唯一大量生产的卤素氧化物。
二氧化氯是在1811年首次製備,廣泛的用在造紙業以及飲用水處理中。近期也將二氧化氯應用在食品處理、住所和車輛消毒、除黴、空氣消毒及去異味、游泳池水處理、牙醫消毒以及傷口清潔上。
二氧化氯被廣泛用于消毒及殺毒。但近來有人利用二氧化氯進行詐騙,將二氧化氯宣传为可治療多種疾病(包括兒童自閉症及COVID-19)的食用藥物。有兒童為治療自閉症而接受二氧化氯的灌肠,以致危及性命。美国食品药品监督管理局(FDA)提出除了在牙科醫師監督下用二氧化氯清洗口部之外,其餘食用二氧化氯或在體內使用二氧化氯的作法對身體沒有好處,不應該使用。
目录
製備方法
| 製備型態 | 備註 | 產物特性 |
|---|---|---|
| 酸製法:
5ClO2− + 4H+ → 4ClO2 + 2H2O + Cl− 5NaClO2 + 4HCl → 4ClO2(aq) + ClO3− |
在酸性環境中反應可產生氯酸根離子,反應速率緩慢。 |
1.需要與進料幫浦連結。 2.產量限制:25~30 lb/day。 3.最大有效產率約80%。 |
| 液氯-亞氯酸鈉:
Cl2 + H2O →HOCl/ HCl HOCl/ HCl+ NaClO2 → ClO2 + H/OCl− + ClO3− + NaOH |
在酸性環境中反應可能產生氯酸根離子反應速率稍慢,須加過量氯和酸與NaOH中和。 |
1.流出液呈酸性(pH~2.8-3.5)。 2.產量限制:~1000 lb/day。 3.最大有效產率約80-92%。 |
| 液氯-亞氯酸鈉 (循環式):
2HOCl + 2NaClO2 → 2ClO2 + Cl2 + 2NaOH |
須加過量氯和酸與NaOH中和飽和液,氯在與亞氯酸鈉混合前須先經過在循環反應槽。 | |
| 液氯-亞氯酸鈉溶液 (真空式): NaClO2(aq)+ Cl2(g) → ClO2(aq)+NaCl |
在中性環境中反應反應速度快速,氯氣與25%亞氯酸鈉溶液經噴射器注入真空式反應槽,無須幫浦輔助。 |
1.產量5-120000 lb/day。 2.流出液呈中性。 3.低餘氯產生量(<2%)。 4.最大有效產率約95-99%。 5.須維持內壓至少40 psig。 |
| 氯氣-固態亞氯酸鈉: NaClO2(s) + Cl2(g) → ClO2(aq) + NaCl |
反應速度快速。
氯氣經氮氣或過濾後,空氣稀釋後再參與反應,可產生~8%二氧化氯蒸汽。 |
1.最大有效產率約>99%。 2.總產量>10000 lb/day。 |
| 電化學法:
ClO2− → ClO2 + e− |
電解25%亞氯酸鈉溶液。 | |
| 氯酸根離子還原法: 2NaClO3 + H2O2 + H2SO4 → 2ClO2 + 2NaSO4 + H2O + O2 |
在酸性環境中反應。 |
二氧化氯是一种与稀释物质分离时会剧烈分解的化合物。因此,通常优选涉及不经过气相而制备溶液的制备方法。二氧化氯必须以安全的方式安排处理。
亚氯酸盐的氧化
在实验室, ClO2 可以由亚氯酸钠和氯气化合而成:
- 2 NaClO2 + Cl2 → 2 ClO2 + 2 NaCl
传统上,消毒剂应用中的二氧化氯是由亚氯酸钠或亚氯酸钠-次氯酸钠方法制成的:
- 2 NaClO2 + 2 HCl + NaOCl → 2 ClO2 + 3 NaCl + H2O
或是亚氯酸钠–盐酸法:
- 5 NaClO2 + 4 HCl → 5 NaCl + 4 ClO2 + 2 H2O
或是亚氯酸盐–硫酸法:
- 4 ClO−
2 + 2 H2SO4 → 2 ClO2 + HClO3 + 2 SO2−
4 + H2O + HCl
这三种方法均可以产生具有高亚氯酸盐转化率的二氧化氯。与其他方法不同,亚氯酸盐-硫酸法可生产完全不含氯的二氧化氯,要生产等量的二氧化氯,其亚氯酸盐的含量要多25%。此外,过氧化氢可有效地用于小规模的应用。
氯酸盐的还原
- 2 KClO3 + 2 H2C2O4 → K2C2O4 + 2 ClO2 + 2 CO2 + 2 H2O
- 2 KClO3 + H2C2O4 + 2 H2SO4 → 2 KHSO4 + 2 ClO2 + 2 CO2 + 2 H2O
今天,超过 95% 的二氧化氯是由氯酸钠还原而成, 用于木浆漂白。 它可以在强酸溶液中以合适的还原剂(例如甲醇,过氧化氢,盐酸或二氧化硫)反应高效生产。 现代技术基于甲醇或过氧化氢,因为这些化学方法可实现最佳经济性,并且不会产生氯气。 它的反应可以写为:
- 氯酸盐 + 酸 + 还原剂→ 二氧化氯 + 副产物
作为一个典型示例,人们认为氯酸钠与盐酸在单个反应器中的反应通过以下途径进行:
-
ClO−
3 + Cl−
+ H+
→ ClO−
2 + HOCl -
ClO−
3 + ClO−
2 + 2 H+
→ 2 ClO
2 + H
2O -
HOCl + Cl−
+ H+
→ Cl
2 + H
2O
总反应为:
- 2 ClO−
3 + 2 Cl−
+ 4 H+
→ 2 ClO
2 + Cl
2 + 2 H
2O.
商业上更重要的生产路线使用甲醇作为还原剂,并使用硫酸进行酸度调节。 不使用基于氯化物的工艺的两个优点是它不会形成有害的氯气,而副产物硫酸钠对制浆厂而言是一种有价值的化学品。 这些基于甲醇的方法可提供很高的效率,并且非常安全。
自1999年以来,由于使用氯酸盐,过氧化氢和硫酸进行的工艺生产效率高,因此已越来越多地用于水处理和其他小规模的消毒剂应用。
其它方法
高纯二氧化氯可以由亚氯酸盐的电解而成:
- 2 NaClO2 + 2 H2O → 2 ClO2 + 2 NaOH + H2
气固法可产生高纯度的二氧化氯气体(空气或氮气中为7.7%),该方法使稀氯气与亚氯酸钠固体反应:
- 2 NaClO2 + Cl2 → 2 ClO2 + 2 NaCl
性質
二氧化氯是一种电中性的氯化合物。 它的结构和性质都和氯气有很大的差别。二氧化氯有着高水溶性,尤其是在冷水中。 二氧化氯不会水解,有着氯气溶解度的10倍,但在光照条件下会在水中发生歧化:6ClO₂+3H₂O→HCl+5HClO₃
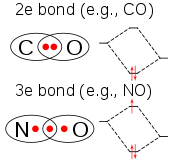
ClO2 的价电子数量是奇数,因此它是顺磁性的自由基。它的电子结构一直困扰着化学家,因为没有一种路易斯结构令人满意。 1933年,L.O.Brockway提出了一种涉及三电子键的结构。 化学家莱纳斯·鲍林进一步发展了这个想法,并得出了两个共振结构,它们的一面是双键,另一面是单键加三电子键。 在鲍林的观点中,后一种组合应该是比双键稍微弱的键。 在分子轨道理论中,如果将第三个电子置于反键轨道上,这种想法是常见的。 后来的工作证实了HOMO确实是一个不完全填充的反键轨道。
二氧化氯化學分子式為ClO2,分子質量為67.452。在常溫下為一種黃綠色到橙色的氣體,沸點為11°C,熔點為-59°C 。當二氧化氯含量達到 14~17 ppm時,一般人就會察覺到它的存在,而濃度達到 45 ppm時,對於嗅覺感官會產生刺激性傷害。二氧化氯具有強氧化的特性,若以其他氧化劑相比,其標準電位值約在1.50伏特之間。而二氧化氯在水中的四個主要氧化還原反應為電中性化合物。在飲用水消毒中,亚氯酸盐 (ClO2−) 是主要反應的產物,有70%是由二氧化氯轉換,其餘則為氯酸盐 (ClO3−) 及氯化物 (Cl−) 。而二氧化氯對於微生物的殺菌效用,不受高pH、氨水、含氮化合物及有機化合物的影響,不會引起溴化物 (次溴酸) 及提供有機溴化合物的組成。
存放性质
在压力超过 10 kPa(或STP下空气中气相浓度大于10%的体积)下,ClO2 可能会猛烈地爆炸,分解形成氯气 和氧气。 分解可以通过光,热点,化学反应或压力冲击来引发。因此,二氧化氯气体绝不会以浓缩形式处理,而是几乎总是以0.5至10克/升的浓度范围溶解在水中作为溶解气体。 它的溶解度在较低的温度下会增加,因此,当以高于3克/升的浓度存储时,通常使用冷水(5℃)。 在许多国家,例如美国,二氧化氯气体可能不会以任何浓度输送,并且几乎总是使用二氧化氯发生器在现场产生。 在某些国家,浓度低于3克/升的二氧化氯溶液可以通过陆路运输,但是它们相对不稳定,并且变化的速度很快。
純度與產製之規範標準
美國國家環境保護署(Environmental Protection Agency,縮寫:EPA)對二氧化氯各種製備有明確規定純度必須大於95%,餘氯量最好小於2%,生成產量、氯殘留量及純度的計算公式,如下公式所列:
A.產量計算公式:
- Yield=[ClO2]× 100% ÷[ClO2]+[ClO2−]+ (
)[ClO3−]
ClO2− ÷ ClO3−之平均分子量比值為 (
B.氯的殘留量計算公式:
- Excess Cl2=[Cl2]× 100% ÷[ClO2]+[ClO2−]+ (
)[ClO3−]× (
× 67.45)
Cl2 ÷ ClO2−之平均分子量比值為 
C.純度計算公式:
- Purity=[ClO2]×100% ÷[ClO2]+[FAC]+[ClO2−]+[ClO3−]
二氧化氯的消毒殺菌機制
二氧化氯本身是一種高選擇性的氧化劑,其殺菌作用機制會依作用物質不同而有不同的反應路徑。由於其具有強氧化能力,幾乎百分之百以分子態存在,除了利用其特殊的單一電子轉移機制,而釋放出新生態的氧原子,利用氧原子本身的強氧化作用及滲透壓差,穿透細菌細胞膜以抑制其呼吸作用,並使磷酸轉移酶失去活性,影響其代謝,藉以殺滅細菌。也可透過將葡萄糖氧化酶 (如硫氫氧化酶) 之雙硫鍵氧化,破壞其鍵結,使蛋白質失去活性,讓細菌無法生存。
一般而言,使用化學藥劑的殺菌消毒機制,可分成下列四種 :
- 破壞細菌及病毒的細胞壁,使其不能分裂生長。
- 傷害其細胞壁的滲透性,而使之無法吸收養分,分泌物無法排出。
- 使其蛋白質變性、凝固,進而喪失其機能。
- 使產生能量的酵素受損,失去活性,進而影響其代謝。
各種消毒劑之優缺點
| 種類 | 優點 | 缺點 |
|---|---|---|
| 二氧化氯 |
1.殺菌效果佳,僅次於臭氧。 2.不生成THMs等有害副產物。 3.可現場製造,省成本,無殘留之問題。 |
1.易揮發。
2.對光、熱敏感而降低殺菌能力,需儲藏於陰暗處。 3.相對費用較高。 |
| 氯 | 1.殺菌效果,排第四位。
2.費用便宜。 3.可同時適用為主要與輔助之消毒劑。 |
1.易產生THMs之致癌物。
2.對呼吸系統有傷害影響。 3.作為輔助消毒時,其操作條件和防止管材腐蝕而控制pH值進而衝突。 4.有殘留的問題。 |
| 臭氧 | 1.殺菌效果極佳,排第一位。
2.至今被證實產生最少之有害副產物。 3.無殘留之問題。 |
1.易揮發
2.臭氧需在現場製造,故較複雜之操作技巧。 3.對有機污染物效果有限。 4.對呼吸系統有傷害影響。 5.生產成本高,費用最高。 |
| 氯胺 | 1.殺菌效果,排第三位。
2.對細菌具輕度之去除效果,且能夠維持長時間之殺菌力。 3.費用便宜。 |
1.會產生有害之副產物。
2.對進行腎透析的病患者具有毒性傷害。 3.僅被推薦為輔助消毒劑用。 4.對病毒及對鞭毛蟲類(Giardia cyst)不具去除能力,殺菌效果最不好。 5.有殘留之問題。 |
分析方法
一般針對氧化劑這類反應速率極快之化學物質,分析方法之選擇依據常為靈敏度的高低、干擾物質的嚴重性及方法的簡易性。因此當氣態二氧化氯溶入於水中時,該二氧化氯溶液極易因操作環境等因素而使得溶液中同時存在有氯、二氧化氯、氯酸根離子及亞氯酸根離子,因此於二氧化氯之濃度與純度分析上較氯之分析來得複雜。基於二氧化氯不穩定之物化特性,於取樣分析之過程中需特別注意避免發生擾動而造成曝氣情形導致二氧化氯揮發溢散,亦需同時有妥善之遮光保存以避免因光照而發生二氧化氯光解反應。由於二氧化氯以高濃度之溶液狀態進行儲備時,亦易因環境因素而有自解並濃度下降之趨勢,因此建議應於產製過程即時量測較為準確,如無可避免需進行儲備時,因妥善避光並儲存於低溫環境,同時於取用時均需重複量測該儲備液之濃度值。以下就水中二氧化氯濃度之分析方法簡述。而國際上所採用之二氧化氯分析方式屬碘滴定法(五步碘量法)之一,係依據Aieta等人於1984年所提出同時測定水中氯、二氧化氯、氯酸根離子及亞氯酸根離子之方法。
「五步碘量法」原理:ClO2、Cl2、ClO2−和ClO3− 有自己最適合與I−反應的pH值,藉以硫代硫酸鈉標準溶液滴定游離的I2,以區分出ClO2、Cl2、ClO2−和ClO3−,如下表所示:
| 化學反應 | pH值範圍 | 添加試劑 |
|---|---|---|
| 2ClO2 + 2I− → I2 + 2ClO2− | =7.0~8.5 | 磷酸緩衝溶液 |
| Cl2 + 2I− → I2 + 2Cl− | <7.0~8.5 | 磷酸緩衝溶液 |
| 2ClO2 + 10I− + 8H+ → 5I2 + 2Cl− + 4H2O | ≦2.0 | 2.5N HCl溶液 |
| ClO2− + 4I−+4H+ → 2I2 + Cl− + 2H2O | ≦2.0 | 2.5N HCl溶液 |
| ClO3− + 6I−+6H+ → 3I2 + Cl− + 3H2O | ≦0.1~0.5 | 2.5N HCl溶液 |
從上表中可見,當pH值=7.0~8.5時,ClO2轉移1莫耳的電子被還原為ClO2−,相當於ClO2被還原為1/5 (按終產物Cl−計);當pH值<7.0~8.5條件下,Cl2會被I−還原為Cl−。在pH值≦2.0時,ClO2轉移5莫耳的電子,完全被I−還原為Cl− (包含原有的ClO2−和ClO2轉化成ClO2−的剩下4/5都被還原)。而pH值≦0.1~0.5時,I−還原全部的ClO3−轉變為Cl− (包括Cl2、ClO2和ClO2−等)。
用途
- 二氧化氯是一種人工製造出來的氣體,對細菌、病毒、黴菌的細胞壁有較強的吸附和穿透能力,能抑制蛋白質合成,達到抑菌、殺菌效果,而且是一種對環境、人體和動物比較友善的綠色消毒劑,通常用在自來水消毒,也是合法的食品用洗潔劑。
- 二氧化氯的主要用途在自來水的消毒,和麵粉與木質紙漿的漂白。
- 作为消毒剂,由于其独特的品质,二氧化氯即使在低浓度下也有效。
- 由於它能氧化及分解蛋白質,能很有效地對抗病毒、細菌和包括梨形鞭毛蟲(學名:Giardia lamblia)與隱孢子蟲(Cryptosporidium)等原生動物所引起的囊腫與卵囊。
- 從1956年比利時的布魯塞爾把自來水消毒劑由氯氣改成二氧化氯後,二氧化氯開始被廣泛地使用。
- 台灣國立屏東科技大學研發團隊研發出超高純度99%與極高濃度3000ppm之二氧化氯相關產品,可對於大環境髒汙細菌汙染進行99%徹底殺菌。。
- 2005年8月,在襲擊紐奧良的飓风卡特里娜過後,二氧化氯就被用來清除被洪水淹沒後房屋上的危險霉菌。而中華民國政府也於2006年3月6日預告二氧化氯為自來水消毒劑。[1]
- 近年也有應用於空調系統及空氣清新機的濾網,以為較多人使用的空間進行空氣消毒殺菌。
- 香港科技大學研究團隊研發出以有機微膠囊包裹二氧化氯的技術(Germagic),透過微膠囊慢慢釋放二氧化氯分子,可長效殺滅及抑制細菌病毒生長。
漂白
有时将二氧化氯与氯结合用于木浆的漂白,但在ECF(无氯元素)漂白过程中单独使用。它在中等酸性(pH3.5至6)下使用。二氧化氯的使用使所产生的有机氯化合物的量最小化。目前,二氧化氯(ECF技术)是全球最重要的漂白方法。 所有漂白的牛皮纸中约有95%是使用二氧化氯按ECF漂白顺序生产的。
水处理
尼亚加拉瀑布城水处理厂于1944年首次使用二氧化氯进行饮用水处理,以销毁产生味道和气味的酚。 1956年,比利时的布鲁塞尔-首都大区从氯气改为二氧化氯,将二氧化氯作为饮用水消毒剂大规模使用。 它在水处理中最常见的用途是作为饮用水氯化之前的氧化剂,以破坏天然水的有机杂质,否则这些杂质会在接触游离氯气时产生三卤甲烷。 三卤甲烷是致癌的消毒副产物 ,它的产生与水中自然含有的有机物的氯化反应有关。 在pH 7以上操作时,二氧化氯优于氯气, 它也可以在氨和胺的存在下用于控制供水系统中的生物膜。 二氧化氯在许多工业水处理应用中用作杀菌剂,包括冷却塔,工艺用水和食品加工。
在公共危机中的用处
二氧化氯作为氧化剂或消毒剂时有许多用途。 二氧化氯可用于空气消毒, 并且是2001年美国炭疽攻击事件后用于美国建筑物净化的主要试剂。在新奥尔良,路易斯安那和周围的墨西哥湾沿岸发生2005年飓风卡特里娜灾难之后,都会使用二氧化氯清除被淹没的房屋中危险的霉菌。
在COVID-19大流行时,美国国家环境保护局已发布了许多符合其针对病原体COVID-19的环境措施标准的消毒剂清单。 尽管每种产品使用不同的配方,但有些是基于可被转化为二氧化氯的亚氯酸钠。 EPA清单上的许多其他产品均包含次氯酸钠(英語:Sodium hypochlorite),其名称相似,但不应与亚氯酸钠(英語:Sodium chlorite)混淆,因为它们具有非常不同的化学作用方式。
其他消毒用途
二氧化氯可以用作熏蒸剂处理,以消毒诸如发霉和发酵的蓝莓,树莓和草莓等水果。
二氧化氯可用于在屠宰家禽后通过喷雾或浸泡将其消毒。
二氧化氯可以用于内视镜的消毒,例如商品名为Tristel的产品。 它也可以三者组合使用,其中包括预先用表面活性剂进行预清洗,然后用去离子水和低浓度的抗氧化剂冲洗。
已证明二氧化氯对消除臭虫有效。
假药
该化合物已被欺诈性地用于治疗多种疾病,包括儿童自闭症。一些人也聲稱可飲用二氧化氯溶液以預防及治療COVID-19。但需在水溶液下才能殺滅,也不能服用及接觸皮膚。一些人聲稱能殺滅COVID-19的配戴式產品含有二氧化氯,但其效能存疑。 被认为是治疗儿童自闭症的方法之一:用二氧化氯对儿童进行灌肠已经发现可以危及生命。 美国食品药品监督管理局(FDA)指出,二氧化氯的摄入或其他内部使用(除了可能在牙医监督下进行的口腔冲洗以外)对健康没有好处,并且出于任何原因都不得在身体内部使用。
二氧化氯的灌肠被认为可以治愈儿童时期的自闭症,导致FDA投诉称其威胁生命, 甚至是死亡。 二氧化氯被标记为多种品牌名称,包括但不限于MMS,Miracle Mineral Solution和CD protocol。 二氧化氯的医学特性没有科学依据,且FDA已警告不要使用二氧化氯。
其它用处
二氧化氯被用作氧化剂,以破坏废水流中的酚,并用于控制动物副产品(提炼)工厂的空气洗涤器中的气味。 它也可以用作汽车和船上的除臭剂,并被水活化并在船上或汽车中过夜放置,从而产生二氧化氯。
安全性
二氧化氯是有毒的,因此需要限制其接触以确保其安全使用。 美国环境保护署已将饮用水中的二氧化氯的最高含量定为0.8毫克/升。美国劳工部的机构职业安全与健康管理局(OSHA)已将空气中二氧化氯的8小时允许暴露极限设置为(0.3 mg/m3)
2010年7月30日以及2010年10月1日,美国食品药品监督管理局都警告不要使用产品奇迹矿物补充剂,又称 MMS。该产品必须按照说明进行配制产生二氧化氯。 MMS已被推销为多种疾病的治疗方法,包括HIV,癌症,自闭症和痤疮。 FDA警告告知消费者,MMS可能对健康造成严重伤害,并表示已收到大量关于因脱水引起的恶心,腹泻,严重呕吐和危及生命的低血压的报道。此警告于2019年8月12日第三次重复,于2020年4月8日第四次重复,指出摄入MMS与喝漂白剂相同,并敦促消费者不要出于任何原因使用它们或将这些产品送给孩子。
参考资料
扩展阅读
- USEPA (1999) EPA guidance manual-alternative disinfectants and oxdants. Chlorine Dioxide (4): 2.
- Petrucci, G., and M. Rosellini (2005) Chlorine dioxide in seawater for fouiling control and post-disinfection in potable waterworks. Desalination, 182(1-3): 283-291.
- Symons, J. M. (1979) Ozone, chlorine dioxide and chloramines as alternatives to chlorine for disinfection of drinking water. In Water Chlorination: Environmental Impact and Health Effects. Vol. 2 (R. L. Jolley et al., eds) Ann Arbor Science. Publ., Ann Arbor, Mich.
- Symons, J. M. (1979) Ozone, chlorine dioxide and chloramines as alternatives to chlorine for disinfection of drinking water. In Water Chlorination: Environmental Impact and Health Effects. Vol. 2 (R. L. Jolley et al., eds) Ann Arbor Science. Publ., Ann Arbor, Mich.
- White, G. C. (1992) The handbook of chlorination and alternative disinfectants. 3rd. Van Nostrand Reinhold Company, New York, p.150-151.
- Lide, D. L. (1990) CRC handbook of chemistry and physics, Seventy-first edition. CRC Press. Boca Raton. Florida.
- Huang, J., L. Wang, N. Ren, F. Ma, and J. Ma (1997) Disinfection effect of chlorine dioxide on bacteria water. Water Research, 31(3): 607-613.
- Aieta, E. M., P. V. Roberts, and M. Hernandez (1984) Determination of chlorine dioxide, chlorine, chlorite, and chlorate in water. Journal American Water Works Association (AWWA), 76(1):64-70.
- 張金松 (2003) 飲用水二氧化氯淨化技術。化學工業出版社,第11-14頁。
- 蔡裡新 (2004) 二氧化氯使用於食品之消毒。食品工業 36(6): 69-76。
- 曾國輝 (1989) 化學(第二冊)。藝軒圖書出版社,632頁。
- 號稱殺滅1米內99%病毒!神奇的「消毒卡」真有效嗎?
- 行政院衛福部食品藥物管理署
外部链接
- National Library of Medicine (US)(页面存档备份,存于互联网档案馆)
- WebElements(页面存档备份,存于互联网档案馆)
- NIST Standard Reference Database(页面存档备份,存于互联网档案馆)
- European Chemicals Bureau
- National Pollutant Inventory - Chlorine dioxide
| ||||||||||||||||||||||
|